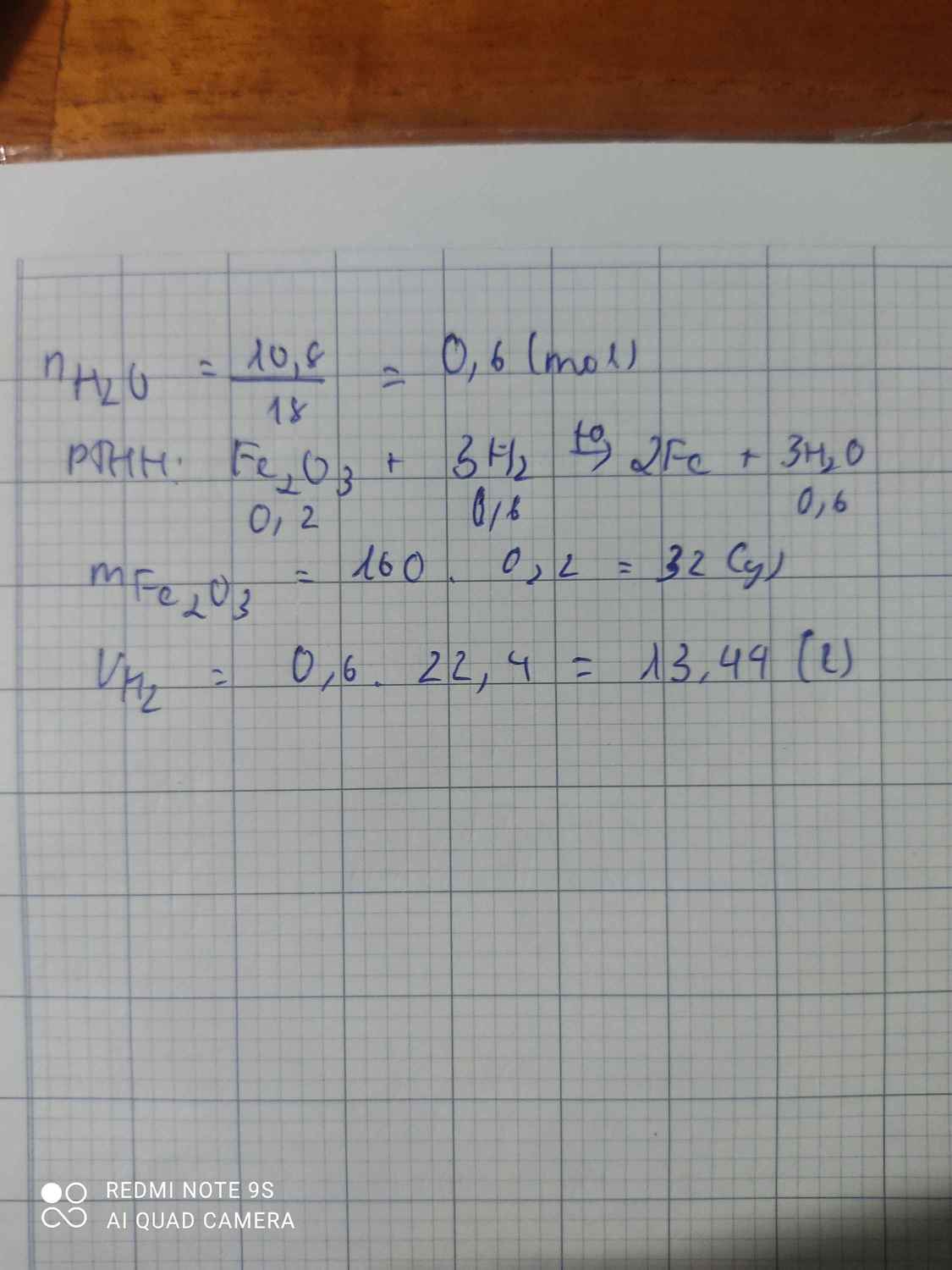Dùng 3,6g khửi Fe2O3 ở nhiệt độ cao. Tính KL Fe tạo ra nếu H=80%

Những câu hỏi liên quan
Cho V lít khí CO phản ứng vs fe2o3 ở nhiệt độ cao tạo thành phe và co2. Nếu cho lượng fe sau phản ứng tan hết trong h2so4 loãng đc 20,16 lít khí hidro đktc.a) tính V CO đã pư đkt.b) nếu hòa tan hết c rắn sau pư khử bđ phải dùng hết 94,9 g HCl thì khối lượng fe2o3 đã dùng nđ là bn?c) nếu sau pư bđ vs cùg kl fe2o3 ns trên toàn bộ khí sau pư khử td vừa đủ vs 3,36 l oxi đktc thì V CO đã dùng nđ ở đkt bn lít?
Đọc tiếp
Cho V lít khí CO phản ứng vs fe2o3 ở nhiệt độ cao tạo thành phe và co2. Nếu cho lượng fe sau phản ứng tan hết trong h2so4 loãng đc 20,16 lít khí hidro đktc.
a) tính V CO đã pư đkt.
b) nếu hòa tan hết c rắn sau pư khử bđ phải dùng hết 94,9 g HCl thì khối lượng fe2o3 đã dùng nđ là bn?
c) nếu sau pư bđ vs cùg kl fe2o3 ns trên toàn bộ khí sau pư khử td vừa đủ vs 3,36 l oxi đktc thì V CO đã dùng nđ ở đkt bn lít?
khử 3,6g hh 2 oxit kl fe2o3 và cuo bằng h2 ở nhiệt độ cao đc 2,64g hh 2 kl. hoàn toàn hh 2 kl trên trong dd hcl dư thì có v lít khí bay ra. xác định m mỗi oxit trong hỗn hợp. tính V
gọi x, y lần lượt là số mol của Fe2O3 và CuO
Fe2O3 + 3H2 → 2Fe + 3H2O
x 2x
CuO + H2 → Cu + H2O
y y
ta có phương trình 160x + 80y = 3,6
112x + 64y = 2,64
⇒ x = y = 0,015
⇒ \(m_{Fe_2O_3}=2,4\left(g\right)\); \(m_{CuO}=1,2\left(g\right)\)
Fe + 2HCl → FeCl2 + H2
0,03 0,03
⇒ V = 22,4. 0,03=0,627(l)
Đúng 0
Bình luận (0)
Fe2O3 + 3H2 --> 2Fe + 3H2O
x -------> 3x ---> 2x
CuO + H2 --> Cu + H2O
y ------>y ----> y
ta có hệ pt sau
112x + 64y = 2,64 và 160x + 80y = 3,6
<=> x = 0,015 và y = 0,015
=> mFe2O3 = 0,015.160 = 2,4 g => mCuO = 80.0,015 = 1,2 g
nH2 = 3.0,015 + 0,015 = 0,06 mol
=> vH2 = 0,06.22,4 = 1,344 lit
Đúng 0
Bình luận (0)
Đặt :
nFe2O3 = x mol
nCuO = y mol
<=> 160x + 80y = 3.6 (1)
Fe2O3 + 3H2 -to-> 2Fe + 3H2O
x________________2x
CuO + H2 -to-> Cu + H2O
y_____________y
<=> 112x + 64y = 2.64 (2)
(1) , (2) :
x = y = 0.015
mFe2O3 = 2.4 g
mCuO = 1.2 g
Fe + 2HCl --> FeCl2 + H2
0.03________________0.03
VH2 = 0.03*22.4 = 0.672 (l)
Đúng 0
Bình luận (0)
Ở nhiet đo cao khí hiđrô cũng khu dc sắt (III) ôxyt (Fe2O3) tạo ra sắt (Fe) và nước (H2O) a)nếu dùng 6,72 lít khí H2 (đktc) ta sẽ khử đc bao nhiêu gam Fe2o3 b)tính khối lượng Fe sinh ra trong phan ung cho biết Fe=56 Ở=16
nH2 = 6.72/22.4 = 0.3 (mol)
Fe2O3 + 3H2 -to-> 2Fe + 3H2O
0.1_____0.3______0.2
mFe2O3 = 0.1*160 = 16 (g)
mFe = 0.2*56 = 11.2 (g)
Đúng 1
Bình luận (0)
Để khử hoàn toàn 16,0 gam Fe2O3 bằng khí CO (ở nhiệt độ cao), phản ứng tạo Fe và khí CO2. Thể tích khí CO (đktc) cần dùng là A. 6,72 B. 2,24 C. 4,48 D. 3,36
Đọc tiếp
Để khử hoàn toàn 16,0 gam Fe2O3 bằng khí CO (ở nhiệt độ cao), phản ứng tạo Fe và khí CO2. Thể tích khí CO (đktc) cần dùng là
A. 6,72
B. 2,24
C. 4,48
D. 3,36
Tính thể tích H2 (đktc) khi khử 3,6g Fe(ll) bằng khí H2 ở nhiệt độ cao
$FeO + H_2 \xrightarrow{t^o} Fe + H_2O$
$n_{H_2} = n_{FeO} = \dfrac{3,6}{72} = 0,05(mol)$
$V_{H_2} = 0,05.22,4 = 1,12(lít)$
Đúng 2
Bình luận (0)
\(n_{FeO}=\dfrac{m}{M}=\dfrac{3,6}{72}=0,05\) ( mol )
FeO + H\(_2\) → Fe + H\(_2\)O
0,05 mol → 0,05 mol → 0,05 mol → 0,05 mol
V\(_{H_2}\) = n . 22,4 = 0,05 . 22,4 = 1,12 ( l )
Đúng 1
Bình luận (0)
: Khử hoàn toàn 12,8 gam Fe2O3 bằng khí hiđro ở nhiệt độ cao. a. Tính thể tích hiđro cần dùng ở đktc?b. Tính khối lượng Fe thu được sau phản ứng?c. Nếu đem toàn bộ lượng Fe thu được ở trên tác dụng với 14,6 gam axit HCl thì thu được bao nhiêu lít H2 (đktc)?
Đọc tiếp
: Khử hoàn toàn 12,8 gam Fe2O3 bằng khí hiđro ở nhiệt độ cao.
a. Tính thể tích hiđro cần dùng ở đktc?
b. Tính khối lượng Fe thu được sau phản ứng?
c. Nếu đem toàn bộ lượng Fe thu được ở trên tác dụng với 14,6 gam axit HCl thì thu được bao nhiêu lít H2 (đktc)?
Để giải bài toán này, ta cần biết phương trình phản ứng giữa oxit sắt (Fe2O3) và khí hidro (H2):
Fe2O3 + 3H2 → 2Fe + 3H2O
Theo đó, mỗi mol Fe2O3 cần 3 mol H2 để khử hoàn toàn thành Fe.
a) Thể tích khí hiđro cần dùng:
Ta cần tìm số mol khí hidro cần dùng để khử hoàn toàn 12,8 gam Fe2O3.Khối lượng mol của Fe2O3 là:M(Fe2O3) = 2x56 + 3x16 = 160 (g/mol)
Số mol Fe2O3 là:n(Fe2O3) = m/M = 12.8/160 = 0.08 (mol)
Theo phương trình phản ứng, mỗi mol Fe2O3 cần 3 mol H2 để khử hoàn toàn thành Fe.Vậy số mol H2 cần dùng là:n(H2) = 3*n(Fe2O3) = 0.24 (mol)
Thể tích khí hidro cần dùng ở đktc là:V(H2) = n(H2)22.4 = 0.2422.4 = 5.376 (lít)
Vậy thể tích khí hiđro cần dùng ở đktc là 5.376 lít.
b) Khối lượng Fe thu được sau phản ứng:
Theo phương trình phản ứng, mỗi mol Fe2O3 tạo ra 2 mol Fe.Vậy số mol Fe thu được là:n(Fe) = 2*n(Fe2O3) = 0.16 (mol)
Khối lượng Fe thu được là:m(Fe) = n(Fe)M(Fe) = 0.1656 = 8.96 (gam)
Vậy khối lượng Fe thu được sau phản ứng là 8.96 gam.
c) Thể tích khí hiđro thu được khi Fe tác dụng với HCl:
Ta cần tìm số mol H2 thu được khi Fe tác dụng với HCl.Theo phương trình phản ứng, mỗi mol Fe tác dụng với 2 mol HCl để tạo ra H2 và muối sắt (FeCl2).Số mol HCl cần dùng để tác dụng với Fe là:n(HCl) = m(HCl)/M(HCl) = 14.6/36.5 = 0.4 (mol)
Vậy số mol H2 thu được là:n(H2) = 2n(Fe) = 2(m(Fe)/M(Fe)) = 2*(8.96/56) = 0.16 (mol)
Thể tích khí hiđro thu được ở đktc là:V(H2) = n(H2)22.4 = 0.1622.4 = 3.584 (lít)
Vậy thể tích khí hiđro thu được ở đktc là 3.584 lít.

Đúng 0
Bình luận (0)
Cho V l khí CO t/d với 46,4 g fe2o3 ở nhiệt độ cao tạo thành fe và co2. Hòa tan hết lg fe phải dùng vừa hết 32,85 g hcl.
a) tính V
b) cho chất rắn sau phản ứng t/d vừa đủ vs bn g hcl
Bài 1: Viết PTHH sau nếu có1. Nhiệt phân KMnO4 và KClO32. Đốt cháy C, Fe, C2H4, FeS2.3. Dung dịch H2SO4 loãng phản ứng với Fe, Al, Cu, Zn4. H2 phản ứng với hỗn hợp (Fe2O3 và MgO) ở nhiệt độ cao. Bài 2: Dùng dung dịch chứa 0,3 mol HCl phản ứng với 2,4 gam Mg. Tính khối lượng từng chất có sau phản ứng? (cho Mg 24, H1, Cl 35,5)
Đọc tiếp
Bài 1: Viết PTHH sau nếu có
1. Nhiệt phân KMnO4 và KClO3
2. Đốt cháy C, Fe, C2H4, FeS2.
3. Dung dịch H2SO4 loãng phản ứng với Fe, Al, Cu, Zn
4. H2 phản ứng với hỗn hợp (Fe2O3 và MgO) ở nhiệt độ cao.
Bài 2: Dùng dung dịch chứa 0,3 mol HCl phản ứng với 2,4 gam Mg. Tính khối lượng từng chất có sau phản ứng? (cho Mg =24, H=1, Cl =35,5)
Bài 1.
1.\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
\(2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\)
2.\(C+O_2\rightarrow\left(t^o\right)CO_2\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
\(C_2H_4+5O_2\rightarrow\left(t^o\right)2CO_2+2H_2O\)
\(4FeS_2+11O_2\rightarrow\left(t^o\right)2Fe_2O_3+8SO_2\)
3.\(Fe+H_2SO_4\rightarrow FéO_4+H_2\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
Cu ko tác dụng với H2SO4 loãng
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
Bài 2.
\(n_{Mg}=\dfrac{m}{M}=0,1mol\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,1 < 0,3 ( mol )
0,1 0,2 0,1 0,1 ( mol )
\(m_{HCl\left(dư\right)}=\left(0,3-0,2\right).36,5=3,65g\)
\(m_{MgCl_2}=n.M=0,1.95=9,5g\)
\(m_{H_2}=n.M=0,1.2=0,2g\)
Đúng 2
Bình luận (0)
1. Biết sắt (III) oxit bị khủ bởi hidro ở nhiệt độ cao theo sơ đồ phản ứng: Fe2O3+H2→ Fe + H2O
a. Viết phương trình hóa học của phản ứng?
b. Nếu có 10,8 gam H2O sinh ra, hãy tính:Khối lượng Fe2O3 phản ứng? Tính thể tích hiđro phản ứng (dktc)