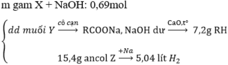cho 19,2 g kim loại M hóa trị 2 tác dụng vừa đủ với dd h2so4 đặc nóng thu được dd x và khí so2 duy nhất .dẫn toàn bộ khí so2 thu được td với 1 lít dd naoh 0,7M thu được dd y cô cạn dd y thu được 41,8 gam chất rắn .xác định kim loại M

Những câu hỏi liên quan
Hòa tan 19,2 g kim loại M bằng dd H2SO4 đặc nóng thu được khí SO2. Lượng khí SO2 hấp thụ hoàn toàn bởi 1 lít dd NaOH 0,7 M, cô cạn sau phản ứng thu được 41,8 g chất rắn khan. Xác định M
2M+2nH2SO4-->M2(SO4)n+nSO2+2nH2O
0.6/n
Xét TH NaOH dư
SO2+2NaOH-->Na2SO3+H2O
a----->2a--------->a
TA có: 126a+40(0.7-2a)=41.8
< = > a=0.3
M=19.2n/0.6=32n
n=2, => M=64 : Cu
Đúng 1
Bình luận (0)
hoà tan 6,72 (g) kloai M vào dd h2so4 đặc, nóng, dư thu được khí so2 (s ảnphẩm khử duy nhất). Dẫn toàn bộ khí so2 trên vào 210ml dd naoh 2M dư thu được dd Y , cô cạn dd Y thu được 25,08(g) chất rắn . Xác định kloai M ? (giúp e vs ạ😭)
hòa tan hoàn toàn 7,87 gam hh b gồm :kim loại zn và một oxit sắt bằng dd h2so4 đặc nóng dư .sau khi pư kết thúc thu được 0,6496 lít khí so2 (là sp khử duy nhất ) và dd y .cô cạn dd y thu được 20,254 gam hh muối khan .xđ cthh của oxit sắt
cho 3,2g gồm hh Fe,S và FeS tác dụng với dd H2SO4 đặc, nóng dư thu được dd X và khí SO2 là sản phẩm khử duy nhất. Biết số mol H2SO4 đã pứ là 0,18mol
Cô cạn dd X thu được bao nhiêu gam muối khan?
Quy đổi hh ban đầu thành \(\left\{{}\begin{matrix}Fe:a\left(mol\right)\\S:b\left(mol\right)\end{matrix}\right.\)
=> 56a + 32b = 3,2 (1)
PTHH: 2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
a------->3a--------->0,5a
S + 2H2SO4 --> 3SO2 + 2H2O
b---->2b
=> 3a + 2b = 0,18 (2)
(1)(2) => a = 0,04 (mol); b = 0,03 (mol)
=> \(n_{Fe_2\left(SO_4\right)_3}=0,02\left(mol\right)\)
=> mFe2(SO4)3 = 0,02.400 = 8 (g)
Đúng 4
Bình luận (0)
Quy đổi hh ban đầu thành \(\left\{{}\begin{matrix}Fe:a\left(mol\right)\\S:b\left(mol\right)\end{matrix}\right.\)
=> 56a + 32b = 3,2 (1)
PTHH: 2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
a------->3a--------->0,5a
S + 2H2SO4 --> 3SO2 + 2H2O
b---->2b
=> 3a + 2b = 0,18 (2)
(1)(2) => a = 0,04 (mol); b = 0,03 (mol)
=> \(n_{Fe_2\left(SO_4\right)_3}=0,02\left(mol\right)\)
=> mFe2(SO4)3 = 0,02.400 = 8 (g)
hoà tan m gam hỗn hợp Cu và Zn vào dd H2SO4 loãng dư thu được dd X, một kim loại khong tan, và 2,479 lít khí (đkc). Lấy toàn bộ lượng kim loại không tan thu được cho hoà tan vào x gam dd H2SO4 đặc nóng 98% thấy thu được 2,9748 lít khí SO2 (đkc) (sản phẩm khử duy nhất) a)PTHH b)tính m,x
a, \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(Cu+2H_2SO_{4\left(đ\right)}\underrightarrow{t^o}CuSO_4+SO_2+2H_2O\)
b, Ta có: \(n_{H_2}=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
\(n_{Zn}=n_{H_2}=0,1\left(mol\right)\)
\(n_{SO_2}=\dfrac{2,9748}{24,79}=0,12\left(mol\right)\)
\(n_{Cu}=n_{SO_2}=0,12\left(mol\right)\)
\(\Rightarrow m=m_{Zn}+m_{Cu}=0,1.65+0,12.64=14,18\left(g\right)\)
Có: \(n_{H_2SO_{4\left(đ\right)}}=2n_{SO_2}=0,24\left(mol\right)\Rightarrow x=m_{ddH_2SO_4\left(đ\right)}=\dfrac{0,24.98}{98\%}=24\left(g\right)\)
Đúng 3
Bình luận (0)
Hỗn hợp X gồm có 3 kim loại Al, Mg, Cu. Lấy 6,7 g hhX tác dụng hết với dd H2SO4 đặc nóng dư thu được 4,48 lit SO2 ở đktc và dd A. Cô cạn dd A thu được m (g) muối khan . Giá trị của m là :
\(n_{SO_2}=\dfrac{4,48}{22,4}=0,2mol\)
\(\Rightarrow n_{H_2SO_4}=2n_{SO_2}=2\cdot0,2=0,4mol\)
\(\Rightarrow n_{SO_4^{2-}}=n_{H_2SO_4}=0,4mol\Rightarrow m_{SO_4^{2-}}=0,4\cdot96=38,4g\)
\(m=m_{SO_4^{2-}}+m_{hhX}=38,4+6,7=45,1g\)
Đúng 2
Bình luận (0)
Đun nóng m g hh X gồm các chất có cùng một loại nhóm chức với 600ml dd NaOH 1,15M thu được dd Y chứa muối của một axit cacboxylic đơn chức và 15,4g hơi Z gồm các ancol. Cho toàn bộ Z tác dụng với Na dư thu được 5,04 lít khí H2. Cô cạn dd Y, nung nóng chất rắn thu được với CaO cho đến khi phản ứng xảy ra hoàn toàn thu được 7,2g một chất khí. Giá trị của m là A. 22,60 B. 40,60 C. 34,30 D. 34,51
Đọc tiếp
Đun nóng m g hh X gồm các chất có cùng một loại nhóm chức với 600ml dd NaOH 1,15M thu được dd Y chứa muối của một axit cacboxylic đơn chức và 15,4g hơi Z gồm các ancol. Cho toàn bộ Z tác dụng với Na dư thu được 5,04 lít khí H2. Cô cạn dd Y, nung nóng chất rắn thu được với CaO cho đến khi phản ứng xảy ra hoàn toàn thu được 7,2g một chất khí. Giá trị của m là
A. 22,60
B. 40,60
C. 34,30
D. 34,51
cho 11,8 g hh X gồm cu và fe vào dd h2so4 loãng dư đến khi pu xảy ra hoàn toàn thì thu được 0,56(l) khí ở kdtc).Cũng lượng X trên cho vào dd h2so4 đặc nóng thì thu được V lít khí so2(dktc),dẫn lượng khí thu được vào 250ml dd naoh 1M,thu được 21,9g muối
a)tính thành phần % khối lượng mỗi kl trong hh ban đầu
b)Tính V
\(n_{H_2}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\)
\(n_{NaOH}=0,25.1=0,25\left(mol\right)\)
Cho X vào dung dịch `H_2SO_4` loãng:
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,025<-----------------------0,025
a. \(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{56.0,025.100\%}{11,8}=11,86\%\\\%m_{Cu}=\dfrac{\left(11,8-0,025.56\right).100\%}{11,8}=88,14\%\end{matrix}\right.\)
b. \(n_{Cu}=\dfrac{11,8-0,025.56}{64}=0,1625\left(mol\right)\)
Cũng lượng X trên cho vào dung dịch `H_2SO_4` đặc nóng:
Giả sử Fe tác dụng hết với dung dịch \(H_2SO_{4.đn}\)
\(2Fe+6H_2SO_{4.đn}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
0,025----------------------------------->0,0375
\(Cu+2H_2SO_{4.đn}\rightarrow CuSO_4+SO_2+2H_2O\)
0,1625--------------------------->0,1625
\(\Sigma n_{SO_2}=0,0375+0,1625=0,2\left(mol\right)\)
Có: \(\dfrac{n_{NaOH}}{n_{SO_2}}=\dfrac{0,25}{0,2}=1,25\)
=> Phản ứng giữa `NaOH` và `SO_2` tạo muối axit trước (tỉ lệ 1:1)
\(SO_2+NaOH\rightarrow NaHSO_3\)
0,2---->0,2------->0,2
Xét \(\dfrac{0,2}{1}< \dfrac{0,25}{1}\Rightarrow\) NaOH dư.
\(n_{NaOH.dư}=0,25-0,2=0,05\left(mol\right)\)
\(NaOH+NaHSO_3\rightarrow Na_2SO_3+H_2O\)
0,05----->0,05---------->0,05
Xét \(\dfrac{0,05}{1}< \dfrac{0,2}{1}\Rightarrow NaHSO_3.dư\)
Sau phản ứng thu được: \(\left\{{}\begin{matrix}n_{NaHSO_3}=0,2-0,05=0,15\left(mol\right)\\n_{Na_2SO_3}=0,05\left(mol\right)\end{matrix}\right.\)
\(m_{muối}=0,15.104+0,05.126=21,9=m_{muối.thu.được.theo.đề}\)
=> Giả sử đúng.
\(\Rightarrow V=V_{SO_2}=0,2.22,4=4,48\left(l\right)\)
Đúng 1
Bình luận (0)
Đun nóng m gam hỗn hợp X gồm các chất có cùng một loại nhóm chức với 720 ml dd NaOH 1,15M, thu được dd Y chứa muối của một axit cacboxylic đơn chức và 18,48 gam hơi Z gồm các ancol. Cho toàn bộ Z tác dụng với Na dư, thu được 6,048 lít khí H2 (đktc). Cô cạn dd Y, nung nóng chất rắn thu được với CaO cho đến khi phản ứng xảy ra hoàn toàn, thu được 8,64 gam một chất khí. Giá trị của m gần nhất với A. 40,8 B. 41,4. C. 27. D. 48,6
Đọc tiếp
Đun nóng m gam hỗn hợp X gồm các chất có cùng một loại nhóm chức với 720 ml dd NaOH 1,15M, thu được dd Y chứa muối của một axit cacboxylic đơn chức và 18,48 gam hơi Z gồm các ancol. Cho toàn bộ Z tác dụng với Na dư, thu được 6,048 lít khí H2 (đktc). Cô cạn dd Y, nung nóng chất rắn thu được với CaO cho đến khi phản ứng xảy ra hoàn toàn, thu được 8,64 gam một chất khí. Giá trị của m gần nhất với
A. 40,8
B. 41,4.
C. 27.
D. 48,6