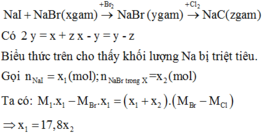hòa tan hoàn toàn 5,6 g Ca trong 100 g H2O thu được dung dịch X. Tính C% của dung dịch X

Những câu hỏi liên quan
1. Hòa tan hoàn toàn 5,4g nhôm cần vừa đủ V(l) dung dịch H2SO4 0,2M sau phản ứng thu được dung dịch B và X (lit) H2(đktc).
a) TÌm V?
b) Tìm X?
c) Tính CM của muối thu được trong dung dịch B?
2. Để hòa tan hoàn toàn m(g) kẽm cần vừa đủ 100(g) dung dịch H2SO4 4,9% .
a) Tìm m?
b) Tìm V lít khí thoát ra ở đktc?
c) Tính C% của muối thu được sau sau phản ứng?
Bài 1 :
Số mol của nhôm
nAl = \(\dfrac{m_{Al}}{M_{Al}}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
Pt : 2Al + 3H2SO4 → Al2(SO4)3 + 3H2\(|\)
2 3 1 3
0,2 0,3 0,3
a) Số mol của dung dịch axit sunfuric
nH2SO4 = \(\dfrac{0,2.3}{2}=0,3\left(mol\right)\)
Thể tích của dung dịch axit sunfuric
CMH2SO4 = \(\dfrac{n}{V}\Rightarrow V=\dfrac{n}{C_M}=\dfrac{0,3}{0,2}=1,5\left(l\right)\)
b) Số mol của khí hidro
nH2 = \(\dfrac{0,3.3}{3}=0,3\left(mol\right)\)
Thể tích của khí hidro ở dktc
VH2 = nH2 . 22,4
= 0,3. 22,4
= 6,72 (l)
Chúc bạn học tốt
Đúng 0
Bình luận (0)
2. Để hòa tan hoàn toàn m(g) kẽm cần vừa đủ 100(g) dung dịch H2SO4 4,9% .
a) Tìm m?
b) Tìm V lít khí thoát ra ở đktc?
c) Tính C% của muối thu được sau sau phản ứng?
---
a) mH2SO4=4,9%.100=4,9(g) -> nH2SO4=4,9/98=0,05(mol)
PTHH: Zn + H2SO4 -> ZnSO4 + H2
Ta có: nZn=nZnSO4=nH2=nH2SO4=0,05(mol)
m=mZn=0,05.65=3,25(g)
b) V(H2,đktc)=0,05.22,4=1,12(l)
c) mZnSO4=0,05. 161=8,05(g)
mddZnSO4=mZn + mddH2SO4 - mH2= 3,25+100 - 0,05.2=103,15(g)
=> C%ddZnSO4= (8,05/103,15).100=7,804%
Đúng 1
Bình luận (0)
Bài 2 :
Khối lượng của axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{4,9.100}{100}=4,9\left(g\right)\)
Số mol của axit sunfuric
nH2SO4 = \(\dfrac{m_{H2SO4}}{M_{H2SO4}}=\dfrac{4,9}{98}=0,05\left(mol\right)\)
Pt : Zn + H2SO4 → ZnSO4 + H2\(|\)
1 1 1 1
0,05 0,05 0,05 0,05
a) Số mol của kẽm
nZn = \(\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
Khối lượng của kẽm
mZn = nZn . MZn
= 0,05 . 65
= 3,25 (g)
b) Số mol của khí hidro
nH2 = \(\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
Thể tích của khí hidro ở dktc
VH2 = nH2 . 22,4
= 0,05 . 22,4
= 1,12 (l)
c) Số mol của muối kẽm clorua
nZnCl2 = \(\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
Khối lượng của muối kẽm sunfat
mZnSO4 = nZnSO4 . MZnSO4
= 0,05 . 161
= 8,05 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mZn + mH2SO4 - mH2
= 3,25 + 100 - (0,05 . 2)
= 103,15 (g)
Nồng độ phàn trăm của muối kẽm sunfat
C0/0ZnSO4= \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{8,05.100}{103,15}=7,8\)0/0
Chúc bạn học tốt
Đúng 0
Bình luận (0)
1. Hòa tan hoàn toàn 16,2(g) kẽm oxit trong 196(g) dung dịch H2SO4 12% sau phản ứng thu được dung dịch X. Tính C% các chất có trong dung dịch X?2. Hòa tan hoàn toàn 16(g) CuO trong 245(g) dung dịch H2SO4 12% sáu phản ứng thu được dung dịch A?3. Hòa tan 16(g) NaOH(rắn) vào nước được 200ml dung dịch NaOH có nồng độ a(M).a) Tìm a?b) Phải thêm vào dung dịch trên bao nhiêu ml nước để thu được dung dịch NaOH 0,5(M)
Đọc tiếp
1. Hòa tan hoàn toàn 16,2(g) kẽm oxit trong 196(g) dung dịch H2SO4 12% sau phản ứng thu được dung dịch X. Tính C% các chất có trong dung dịch X?
2. Hòa tan hoàn toàn 16(g) CuO trong 245(g) dung dịch H2SO4 12% sáu phản ứng thu được dung dịch A?
3. Hòa tan 16(g) NaOH(rắn) vào nước được 200ml dung dịch NaOH có nồng độ a(M).
a) Tìm a?
b) Phải thêm vào dung dịch trên bao nhiêu ml nước để thu được dung dịch NaOH 0,5(M)
Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 21,9 g X vào nước thu được 1,12 lít khí H2 đktc và dung dịch Y trong đó có 5,6 g dung dịch NaOH. Cho toàn bộ Y tác dụng với 100 ml dung dịch Al2(SO4)3 0,5M thu được m gam kết tủa. Giá trị của m là A. 29,52 B. 27,96 C. 1,56 D. 36,52
Đọc tiếp
Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 21,9 g X vào nước thu được 1,12 lít khí H2 đktc và dung dịch Y trong đó có 5,6 g dung dịch NaOH. Cho toàn bộ Y tác dụng với 100 ml dung dịch Al2(SO4)3 0,5M thu được m gam kết tủa. Giá trị của m là
A. 29,52
B. 27,96
C. 1,56
D. 36,52
Giải thích:
Quy đổi X thành Na : x mol, Ba: y mol và O : z mol
→ 23x + 137y + 16z =21,9
Cho X vào nước : Na → Na+1 + 1e
Ba → Ba+2 + 2e
O + 2e → O-2
2H+1 + 2e → H2
Bảo toàn e có x + 2y -2z = 0,05.2
nNaOH = x = 0,14 nên y = 0,12 mol và z = 0,14 mol → dd Y có 0,14 mol NaOH và 0,12 mol Ba(OH)2
nAl2(SO4)3 = 0,05 mol
SO42- + Ba2+ → BaSO4
Ban đầu : 0,15 mol 0,12 mol
Sau phản ứng 0,12 mol
Al3+ + 3 OH- → Al(OH)3
Ban đầu 0,1 mol 0,38 mol
Sau phản ứng 0 0,08 mol 0,1 mol
Al(OH)3 + OH- → AlO2- + H2O
Ban đầu 0,1 mol 0,08 mol
Sau phản ứng 0,02 mol
Kết tủa có m = 0,12.233 + 0,02.78 = 29,52
Đáp án A
Đúng 0
Bình luận (0)
Hỗn hợp X gồm Na, Ba,
Na
2
O
và BaO. Hòa tan hoàn toàn 21,9 g X vào nước thu được 1,12 lít khí
H
2
đktc và dung dịch Y trong đó có 5,6 g dung dịch NaOH. Cho toàn bộ Y tác dụng với 100 ml dung dịch
Al
2
(
SO
4...
Đọc tiếp
Hỗn hợp X gồm Na, Ba, Na 2 O và BaO. Hòa tan hoàn toàn 21,9 g X vào nước thu được 1,12 lít khí H 2 đktc và dung dịch Y trong đó có 5,6 g dung dịch NaOH. Cho toàn bộ Y tác dụng với 100 ml dung dịch Al 2 ( SO 4 ) 3 0,5M thu được m gam kết tủa. Giá trị của m là
A. 1,56
B. 36,51
C. 27,96
D. 29,52
Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 21,9 g X vào nước thu được 1,12 lít khí H2 đktc và dung dịch Y trong đó có 5,6 g dung dịch NaOH. Cho toàn bộ Y tác dụng với 100 ml dung dịch Al2(SO4)3 0,5M thu được m gam kết tủa. Giá trị của m là A. 1,56 B. 36,51 C. 27,96 D. 29,52
Đọc tiếp
Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 21,9 g X vào nước thu được 1,12 lít khí H2 đktc và dung dịch Y trong đó có 5,6 g dung dịch NaOH. Cho toàn bộ Y tác dụng với 100 ml dung dịch Al2(SO4)3 0,5M thu được m gam kết tủa. Giá trị của m là
A. 1,56
B. 36,51
C. 27,96
D. 29,52
Giải thích:
Quy đổi X thành Na : x mol, Ba: y mol và O : z mol
→ 23x + 137y + 16z =21,9
Cho X vào nước : Na → Na+1 + 1e
Ba → Ba+2 + 2e
O + 2e → O-2
2H+1 + 2e → H2
Bảo toàn e có x + 2y -2z = 0,05.2
nNaOH = x = 0,14 nên y = 0,12 mol và z = 0,14 mol → dd Y có 0,14 mol NaOH và 0,12 mol Ba(OH)2
nAl2(SO4)3 = 0,05 mol
SO42- + Ba2+ → BaSO4
Ban đầu : 0,15 mol 0,12 mol
Sau phản ứng 0,12 mol
Al3+ + 3 OH- → Al(OH)3
Ban đầu 0,1 mol 0,38 mol
Sau phản ứng 0 0,08 mol 0,1 mol
Al(OH)3 + OH- → AlO2- + H2O
Ban đầu 0,1 mol 0,08 mol
Sau phản ứng 0,02 mol
Kết tủa có m = 0,12.233 + 0,02.78 = 29,52
Đáp án D
Đúng 0
Bình luận (0)
Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 21,9 g X vào nước thu được 1,12 lít khí H2 đktc và dung dịch Y trong đó có 5,6 g dung dịch NaOH. Cho toàn bộ Y tác dụng với 100 ml dung dịch Al2(SO4)3 0,5M thu được m gam kết tủa. Giá trị của m là A. 1,56 B. 36,51 C. 27,96 D. 29,52
Đọc tiếp
Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 21,9 g X vào nước thu được 1,12 lít khí H2 đktc và dung dịch Y trong đó có 5,6 g dung dịch NaOH. Cho toàn bộ Y tác dụng với 100 ml dung dịch Al2(SO4)3 0,5M thu được m gam kết tủa. Giá trị của m là
A. 1,56
B. 36,51
C. 27,96
D. 29,52
Đáp án D
Quy đổi X thành Na : x mol, Ba: y mol và O : z mol
→ 23x + 137y + 16z =21,9
Cho X vào nước : Na → Na+1 + 1e
Ba → Ba+2 + 2e
O + 2e → O-2
2H+1 + 2e → H2
Bảo toàn e có x + 2y -2z = 0,05.2
nNaOH = x = 0,14 nên y = 0,12 mol và z = 0,14 mol → dd Y có 0,14 mol NaOH và 0,12 mol Ba(OH)2
nAl2(SO4)3 = 0,05 mol
SO42- + Ba2+ → BaSO4
Ban đầu : 0,15 mol 0,12 mol
Sau phản ứng 0,12 mol
Al3+ + 3 OH- → Al(OH)3
Ban đầu 0,1 mol 0,38 mol
Sau phản ứng 0 0,08 mol 0,1 mol
Al(OH)3 + OH- → AlO2- + H2O
Ban đầu 0,1 mol 0,08 mol
Sau phản ứng 0,02 mol
Kết tủa có m = 0,12.233 + 0,02.78 = 29,52
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn x (g) hỗn hợp: NaI và NaBr vào nước thu được dung dịch X. Cho Br2 dư vào X được dung dịch Y. Cô cạn Y thu được y (g) chất rắn khan. Tiếp tục hòa tan y (g) chất rắn khan trên vào nước thu được dung dịch Z. Cho Cl2 dư vào Z thu được dung dịch T. Cô cạn T được z (g) chất rắn khan. Biết các phản ứng xảy ra hoàn toàn và 2y x + z. Phần trăm khối lượng NaBr trong hỗn hợp đầu bằng: A. 7,3% B. 4,5% C. 3,7% D. 6,7%
Đọc tiếp
Hòa tan hoàn toàn x (g) hỗn hợp: NaI và NaBr vào nước thu được dung dịch X. Cho Br2 dư vào X được dung dịch Y. Cô cạn Y thu được y (g) chất rắn khan. Tiếp tục hòa tan y (g) chất rắn khan trên vào nước thu được dung dịch Z. Cho Cl2 dư vào Z thu được dung dịch T. Cô cạn T được z (g) chất rắn khan. Biết các phản ứng xảy ra hoàn toàn và 2y = x + z. Phần trăm khối lượng NaBr trong hỗn hợp đầu bằng:
A. 7,3%
B. 4,5%
C. 3,7%
D. 6,7%
Hòa tan hoàn toàn 2,24 gam CaO vào cốc thủy tinh chứa 87,76gam H2O dư, thu được dung dịch X
a) Viết PTHH
b) Dung dịch X chứa những chất gì? Tính khối lượng từng chất có trong dung dịch X?
c) Tính khối lượng dung dịch X theo 2 cách
d) Tính nồng độ % của dung dịch X
PTHH: \(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
Ta có: \(n_{CaO}=\dfrac{2,24}{56}=0,04\left(mol\right)=n_{Ca\left(OH\right)_2}\)
\(\Rightarrow m_{Ca\left(OH\right)_2}=0,04\cdot74=2,96\left(g\right)\)
Mặt khác: \(m_{dd}=m_{CaO}+m_{H_2O}=90\left(g\right)\)
\(\Rightarrow C\%_{Ca\left(OH\right)_2}=\dfrac{2,96}{90}\cdot100\%\approx3,3\%\)
Đúng 3
Bình luận (0)
Hòa tan hoàn toàn 2,24 gam CaO vào cốc thủy tinh chứa 87,76gam H2O dư, thu được dung dịch X
a) Viết PTHH
CaO + H2O -------> Ca(OH)2
b) Dung dịch X chứa những chất gì? Tính khối lượng từng chất có trong dung dịch X?
Dung dịch X gồm Ca(OH)2, H2O dư
\(n_{CaO}=n_{H_2O\left(pứ\right)}=n_{Ca\left(OH\right)_2}=\dfrac{2,24}{56}=0,04\left(mol\right)\)
\(\Rightarrow m_{H_2O\left(dư\right)}=87,76-0,04.18=87,04\left(g\right)\)
\(m_{Ca\left(OH\right)_2}=0,04.74=2,96\left(g\right)\)
c) Tính khối lượng dung dịch X theo 2 cách
Cách 1: Bảo toàn khối lượng => \(m_{ddX}=2,24+87,76=90\left(g\right)\)
Cách 2: \(m_{ddX}=m_{Ca\left(OH\right)_2}+m_{H_2Odư}=2,96+87,04=90\left(g\right)\)
d) Tính nồng độ % của dung dịch X
\(C\%_{Ca\left(OH\right)_2}=\dfrac{2,96}{90}.100=3,29\%\)
Đúng 2
Bình luận (0)
\(n_{CaO}=\dfrac{2.24}{56}=0.04\left(mol\right)\)
\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
\(0.04......................0.04\)
X : Ca(OH)2
\(m_{Ca\left(OH\right)_2}=0.04\cdot74=2.96\left(g\right)\)
\(m_{ddX}=2.24+87.76=90\left(g\right)\)
Đề câu c hơi bị nhầm lẫn nhỉ ?
\(C\%_{Ca\left(OH\right)_2}=\dfrac{2.96}{90}\cdot100\%=3.28\%\)
Đúng 2
Bình luận (0)
Hỗn hợp X gồm Na, Ba,
Na
2
O
và BaO. Hòa tan hoàn toàn 21,9 gam X vào nước thu được 1,12 lít khí
H
2
(đktc) và dung dịch Y trong đó có 5,6 gam dung dịch NaOH. Cho toàn bộ Y tác dụng với 100 ml dung dịch
Al
2
SO
4
3
0,5M thu được m gam kết tủa. Giá trị của m là A. 29,52 ...
Đọc tiếp
Hỗn hợp X gồm Na, Ba, Na 2 O và BaO. Hòa tan hoàn toàn 21,9 gam X vào nước thu được 1,12 lít khí H 2 (đktc) và dung dịch Y trong đó có 5,6 gam dung dịch NaOH. Cho toàn bộ Y tác dụng với 100 ml dung dịch Al 2 SO 4 3 0,5M thu được m gam kết tủa. Giá trị của m là
A. 29,52
B. 27,96
C. 1,56
D. 36,52