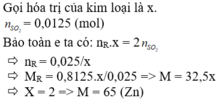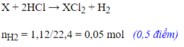Hoà tan hoàn toàn 10.8g kim loại R cần 600g dung dịch H2SO4 9,8%. Xác định tên và kí hiệu hoá học của kim loại

Những câu hỏi liên quan
Hoà tan hoàn toàn Kim loại R trong 200ml dung dịch H2SO4 loãng không phải 2M xác định tên kim loại
Hoà tan hoàn toàn Kim loại R trong 200ml dung dịch H2SO4 loãng không phải 2M xác định tên kim loại
=>???
Đúng 1
Bình luận (1)
Hòa tan hoàn toàn 0,8 g một kim loại hoá trị II hoà tan hoàn toàn trong 100 ml H 2 S O 4 0,5 M. Lượng axit còn dư phản ứng vừa đủ với 33,4 ml dung dịch NaOH 1,00 M. Xác định tên kim loại.
Số mol H 2 S O 4 trong 100ml dung dịch 0,5M là :
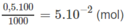
Số mol NaOH trong 33,4 ml nồng độ 1M :
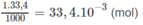
H 2 S O 4 + 2NaOH → N a 2 S O 4 + 2 H 2 O
Lượng H 2 S O 4 đã phản ứng với NaOH :

Số mol H 2 S O 4 đã phản ứng với kim loại là :
5. 10 - 2 - 1.67. 10 - 2 = 3,33. 10 - 2 mol
Dung dịch H 2 S O 4 0,5M là dung dịch loãng nên :
X + H 2 S O 4 → X S O 4 + H 2 ↑
Số mol X và số mol H 2 S O 4 phản ứng bằng nhau, nên :
3,33. 10 - 2 mol X có khối lượng 0,8 g
1 mol X có khối lượng: 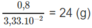
⇒ Mkim loại = 24 g/mol.
Vậy kim loại hoá trị II là magie.
Đúng 0
Bình luận (0)
Hoà tan hoàn toàn 8,0 gam một oxit kim loại A (A có hoá trị II trong hợp chất) cần dùng vừa đủ 400ml dung dịch HCl 1M
1. Xác định kim loại A và công thức hoá học của oxit.
2. Cho 8,4 gam ACO3 tác dụng với 500ml dung dịch H2SO4 1M đến khi phản ứng xảy ra hoàn toàn. Tính nồng độ mol của các chất trong dung dịch sau phản ứng (coi thể tích dung dịch sau phản ứng vẫn là 500 ml).
1) Gọi công thức của oxit là AO. Số mol HCl là 0,4.1=0,4 (mol).
AO (0,2 mol) + 2HCl (0,4 mol) \(\rightarrow\) ACl2 + H2\(\uparrow\).
Phân tử khối của oxit là 8,0/0,2=40 (g/mol).
Vậy A là magie (Mg) và công thức hóa học của oxit là MgO.
2) Số mol MgCO3 và H2SO4 lần lượt là 8,4/84=0,1 (mol) và 0,5.1=0,5 (mol).
Các chất tan trong dung dịch sau phản ứng gồm MgSO4 (0,1 mol) và H2SO4 dư (0,4 mol) có nồng độ mol lần lượt là 0,1/0,5=0,2 (M) và 0,4/0,5=0,8 (M).
Đúng 2
Bình luận (0)
\(1,n_{HCl}=0,4.1=0,4\left(mol\right)\\ PTHH:AO+2HCl\rightarrow ACl_2+H_2O\\ Mol:0,2\leftarrow0,4\\ M_{AO}=\dfrac{8}{0,2}=40\left(\dfrac{g}{mol}\right)\\ \Leftrightarrow A+16=40\\ \Leftrightarrow A=24\left(\dfrac{g}{mol}\right)\\ \Leftrightarrow A.là.Mg\\ CTHH:MgO\)
\(2,n_{H_2SO_4}=1.0,5=0,5\left(mol\right)\\ PTHH:MgCO_3+H_2SO_4\rightarrow MgSO_4+CO_2\uparrow+H_2O\\ Mol:0,5\leftarrow0,5\rightarrow0,5\\ C_{M\left(MgSO_4\right)}=\dfrac{0,5}{0,5}=1M\)
\(1,n_{HCl}=0,4.1=0,4\left(mol\right)\\ PTHH:AO+2HCl\rightarrow ACl_2+H_2O\\ Mol:0,2\leftarrow0,4\\ M_{AO}=\dfrac{8}{0,2}=40\left(\dfrac{g}{mol}\right)\\ \Leftrightarrow A+16=40\\ \Leftrightarrow A=24\left(\dfrac{g}{mol}\right)\\ \Rightarrow A.là.Mg\\ CTHH:MgO\)
\(2,n_{MgCO_3}=\dfrac{8,4}{84}=0,1\left(mol\right)\\ n_{H_2SO_4}=1.0,5=0,5\left(mol\right)\\ PTHH:MgCO_3+H_2SO_4\rightarrow MgSO_4+CO_2\uparrow+H_2O\\ LTL:0,1< 0,5\Rightarrow H_2SO_4.dư\\ Theo.pt:n_{H_2SO_4\left(pư\right)}=n_{MgSO_4}=n_{MgCO_3}=0,1\left(mol\right)\\ C_{MMgSO_4}=\dfrac{0,1}{0,5}=0,2M\\ C_{MH_2SO_4\left(dư\right)}=\dfrac{0,4}{0,5}=0,8M\)
Đúng 1
Bình luận (0)
hoà tan hoàn toàn 10,2g một oxit kim loại có hoá trị 3 vào 100g dung dụng h2so4 vừa đủ sau khi phản ứng xảy ra hoàn toàn thu được 34,2 g muối sunfat a)xác định tên kim loại b) tính nồng độ % của dung dịch h2so4 c) tính thể tích dung dịch NaOH 1,5 M cần dùng để kết tủa hoàn toàn dung dịch muối trên
\(Đặt.oxit:A_2O_3\\ A_2O_3+3H_2SO_4\rightarrow A_2\left(SO_4\right)_3+3H_2O\\ n_{Al_2O_3}=\dfrac{34,2-10,2}{96.3-16.3}=0,1\left(mol\right)\\ M_{A_2O_3}=\dfrac{10,2}{0,1}=102\left(\dfrac{g}{mol}\right)=2M_A+48\\ \Rightarrow M_A=27\left(\dfrac{g}{mol}\right)\\ a,\Rightarrow A.là.nhôm\left(Al=27\right)\\ b,n_{H_2SO_4}=3.0,1=0,3\left(mol\right)\\ C\%_{ddH_2SO_4}=\dfrac{0,3.98}{100}.100=29,4\%\\ c,n_{Al_2\left(SO_4\right)_3}=n_{Al_2O_3}=0,1\left(mol\right)\\ Al_2\left(SO_4\right)_3+6NaOH\rightarrow2Al\left(OH\right)_3+3Na_2SO_4\\ n_{NaOH}=6.0,1=0,6\left(mol\right)\\ V_{ddNaOH}=\dfrac{0,6}{1,5}=0,4\left(l\right)\)
Đúng 3
Bình luận (0)
Hoà tan hoàn toàn 0,32g một kim loại hoá trị 2 vào dung dịch H2SO4 đặc nóng,lượng khí thoát ra hấp thụ hết bởi 45 ml dung dịch NaOH 0,2M .Tạo dung dịch chứa 0,608g muối.Xác định tên kim loại?
$n_{NaOH} = 0,045.0,2 = 0,009(mol)$
Gọi $n_{Na_2SO_3} = a ;n_{NaHSO_3} = b$
$2NaOH + SO_2 \to Na_2SO_3 + H_2O$
$NaOH + SO_2 \to NaHSO_3 + H_2O$
Ta có :
$2a + b = 0,009$
$126a + 104b = 0,608$
Suy ra: a = 0,004 ; b = 0,001
$n_{SO_2} = a + b = 0,005(mol)$
Gọi kim loại cần tìm là R
$R + 2H_2SO_{4_{đặc}} \xrightarrow{t^o} RSO_4 + SO_2 + 2H_2O$
$n_R = n_{SO_2} = 0,005(mol)$
$M_R = \dfrac{0,32}{0,005} = 64(Cu)$
Kim loại cần tìm : Đồng
Đúng 3
Bình luận (1)
Hoà tan hoàn toàn 0,8125g kim loại R hoá trị II và dung dịch H2SO4 đặc nóng thu được 0,28 kít khí SO2 (đktc).Kim loại R là: A. Mg B. Cu C. Zn D. Fe
Đọc tiếp
Hoà tan hoàn toàn 0,8125g kim loại R hoá trị II và dung dịch H2SO4 đặc nóng thu được 0,28 kít khí SO2 (đktc).Kim loại R là:
A. Mg
B. Cu
C. Zn
D. Fe
Hoà tan hoàn toàn 3,25g một kim loại X (hoá trị II) bằng dung dịch HCl thu được 1,12 lít khí H 2 (ở đktc). Hãy xác định tên kim loại X ?
Cho 1,44g một kim loại R có hoá trị II phản ứng hoàn toàn trong 250ml dung dịch H2SO4 0,3M. Dung dịch thu được còn chứa axit dư và phải trung hoà axit dư bằng 60ml dung dịch NaOH 0,5M. Hãy xác định kim loại R
\(n_{NaOH}=0.06\cdot0.5=0.03\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=\dfrac{0.03}{2}=0.015\left(mol\right)\)
\(n_{H_2SO_4\left(pư\right)}=0.25\cdot0.3-0.015=0.06\left(mol\right)\)
\(R+H_2SO_4\rightarrow RSO_4+H_2\)
\(0.06....0.06\)
\(M_R=\dfrac{1.44}{0.06}=24\left(\dfrac{g}{mol}\right)\)
\(R:Mg\)
Đúng 3
Bình luận (0)
n NaOH = 0,06.0,5 = 0,03(mol)
$2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O$
n H2SO4 dư = 1/2 n NaOH = 0,015(mol)
n H2SO4 pư = 0,25.0,3 - 0,015 = 0,06(mol)
$R + H_2SO_4 \to RSO_4 + H_2$
n R = n H2SO4 pư = 0,06(mol)
M R = 1,44/0,06 = 24(Mg)
Vậy R là Magie
Đúng 3
Bình luận (0)
hoà tan một muối cacbonat của kim loại R ( chưa biết hoá trị ) trong một lượng vừa đủ dung dịch H2SO4 12,25% thu được dung dịch muối sunfat của kim loại R có nồng độ 17,431%. Xác định kim loại R
tham khảo
Coi mdd H2SO4=100(gam)mdd H2SO4=100(gam)
nR2(SO4)n=nR2(CO3)n=nH2SO4n=0,1n(mol)nR2(SO4)n=nR2(CO3)n=nH2SO4n=0,1n(mol)
Sau phản ứng ,
mR2(SO4)n=0,1n(2R+96n)=0,2Rn+9,6(gam)mR2(SO4)n=0,1n(2R+96n)=0,2Rn+9,6(gam)
Đúng 0
Bình luận (0)