Trong 400 gam dung dịch Nacl có 8 gam muối khan vậy nồng độ phần trăm là bao nhiêu

Những câu hỏi liên quan
Một dung dịch có hòa tan hai muối là NaCl và NaBr. Nồng độ phần trăm của hai muối trong dung dịch bằng nhau. Biết rằng 50 gam dung dịch muối trên tác dụng vừa đủ 50 ml dung dịch
A
g
N
O
3
8% (có khối lượng riêng là 1,0625 g/cm3). Nồng độ phần trăm của NaCl trong dung dịch là A. 1,86% B. 1,46% C. 2,92% D. 0,93%
Đọc tiếp
Một dung dịch có hòa tan hai muối là NaCl và NaBr. Nồng độ phần trăm của hai muối trong dung dịch bằng nhau. Biết rằng 50 gam dung dịch muối trên tác dụng vừa đủ 50 ml dung dịch A g N O 3 8% (có khối lượng riêng là 1,0625 g/cm3). Nồng độ phần trăm của NaCl trong dung dịch là
A. 1,86%
B. 1,46%
C. 2,92%
D. 0,93%
Chọn đáp án A
m d d A g N O 3 = V.D = 50.1,0625 = 53,125 (gam)
ð m A g N O 3 = 53 , 125 . 8 100 = 4,25 (gam) => n A g N O 3 = 4 , 25 170 = 0,025 (mol)
Nồng độ % của 2 muối bằng nhau => Khối lượng 2 muối bằng nhau.
N a C l : x m o l N a B r : y m o l → x + y = 0 , 025 58 , 5 x = 103 y → x = 0 , 0159 y = 0 , 0091
ð
C
%
N
a
C
l
=
0
,
0159.58
,
5
50
.100% = 1,86%
Đúng 0
Bình luận (0)
Tính nồng độ phần trăm của các dung dịch sau :
a. Hòa tan 50 gam NaCl vào 120 gam nước.
b. Trong 120 gam dung dịch NaOH có hoà tan 8 gam NaOH khan.
a)
mdd = m NaCl + m H2O = 120 + 50 = 170(gam)
C% NaCl = 50/170 .100% = 29,41%
b)
C% NaOH = 8/120 .100% = 6,67%
Đúng 1
Bình luận (0)
Bài 4. Hòa tan 7,1 gam Na2SO4 ; 7,45 gam KCl ; 2,925 gam NaCl vào nước để được 1 lít dung dịch A.
Tính nồng độ mol/lít của mỗi ion trong dung dịch A.
Cần dùng bao nhiêu mol NaCl và bao nhiêu mol K2SO4 để pha thành 400 ml dung dịch muối có nồng độ ion như trong dung dịch A.
Có thể dùng 2 muối KCl và Na2SO4 để pha thành 400 ml dung dịch muối có nồng độ ion như dung dịch A được không?
1/ Trong 300 gam dung dịch NaOH có hòa tan 60 gam NaOH. Vậy dung dịch đó có nồng độ bao nhiêu phần trăm?
2/ Hãy tính sô gam HCl có trong 150 gam dd HCl nồng độ 12%.
3/ cần lấy bao nhiêu gam dd Na2CO3 nồng độ 15% để trong đó có 20 gam Na2CO3
1. \(C\%_{NaOH}=\dfrac{60}{300}.100\%=20\%\)
2. \(m_{HCl}=150.12\%=18\left(g\right)\)
3. \(m_{ddNa_2CO_3}=\dfrac{20}{15\%}=\dfrac{400}{3}\left(g\right)\)
Đúng 1
Bình luận (0)
nồng độ phần trăm của nước muối là tỉ số phần trăm của số gam muối ăn và nước muối nếu thêm 300g dung dịch nước muối có nồng độ 24% vào 500g dung dịch nước muối có nồng độ 15% thì thu được nước muối có nồng độ là bao nhiêu
Lượng muối trong \(300g\) dung dịch nước muối có nồng độ \(24\%\)là:
\(300\times24\%=72\left(g\right)\)
Lượng muối trong \(500g\) dung dịch nước muối có nồng độ \(15\%\) là:
\(500\times15\%=75\left(g\right)\)
Khối lượng muối trong dung dịch sau khi trộn hai dung dịch là:
\(72+75=147\left(g\right)\)
Khối lượng dung dịch sau khi trộn là:
\(300+500=800\left(g\right)\)
Nồng độ nước muối sau khi trộn là:
\(147\div800\times100\%=18,375\%\)
Đúng 0
Bình luận (0)
Hòa tan 10,8 gam nhôm trong 400 gam dung dịch HCl 14,6% thu được dung dịch A và khí hidro. Tính nồng độ phần trăm muối có trong dung dịch A .
\(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
\(n_{HCl}=\dfrac{400.14,6\%}{36,5}=1,6\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
Xét tỉ lệ: \(\dfrac{0,4}{2}< \dfrac{1,6}{6}\) => Al hết, HCl dư
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,4------------->0,4---->0,6
mdd sau pư = 10,8 + 400 - 0,6.2 = 409,6 (g)\(C\%_{AlCl_3}=\dfrac{0,4.133,5}{409,6}.100\%=13,037\%\)
Đúng 4
Bình luận (0)
Cho 5,4 gam kim loại M và 25,2 gam NaHCO3 vào a gam dung dịch HCl, khuấy đều cho đến khi các chất rắn tan hoàn toàn thu được dung dịch X, trong đó nồng độ phần trăm của muối clorua kim loại M, của NaCl và của HCl dư lần lượt là 13,397%; 8,806%; 1,831%, Nồng độ phần trăm của dung dịch HCl ban đầu là A. 20,00%. B. 10,00%. C. 36,50%. D. 30,00%.
Đọc tiếp
Cho 5,4 gam kim loại M và 25,2 gam NaHCO3 vào a gam dung dịch HCl, khuấy đều cho đến khi các chất rắn tan hoàn toàn thu được dung dịch X, trong đó nồng độ phần trăm của muối clorua kim loại M, của NaCl và của HCl dư lần lượt là 13,397%; 8,806%; 1,831%, Nồng độ phần trăm của dung dịch HCl ban đầu là
A. 20,00%.
B. 10,00%.
C. 36,50%.
D. 30,00%.
Đáp án A
Gọi n là hoá trị của M; x là số mol của M
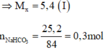
Phương trình hoá học:
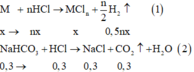
Dung dịch X thu được gồm NaCl: 0,3 mol; MCn: x mol; HCl dư

Tổ hợp (I) và (II) ta được:
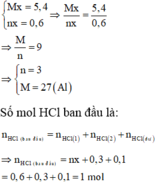
Số mol các khí thu được theo (1), (2) là:
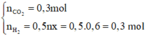
Nồng độ phần trăm của NaCl trong dung dịch X là:
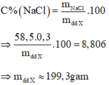
Mặt khác, ta có:
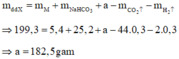
Nồng độ phần trăm dung dịch HCl ban đầu là:
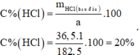
Đúng 0
Bình luận (0)
Hoà tan 15 gam muối ăn vào nước được 60 gam dung dịch. Nồng độ phần trăm của dung dịch này là bao nhiêu
Có 26,6 g hỗn hợp gồm kcl và NaCl hòa tan hỗn hợp vào nước thành 500 gam dung dịch X Cho dung dịch X tác dụng với AgNO3 dư thì tạo thành 57,4 gam kết tủa nồng độ phần trăm mỗi muối trong dung dịch X là
Xem chi tiết
Chúc bạn học tốt !!!
\(m_{hh}=74.5a+58.5b=26.6\left(g\right)\left(1\right)\)
\(n_{AgCl}=\dfrac{57.4}{143.5}=0.4\left(mol\right)\)
\(KCl+AgNO_3\rightarrow KNO_3+AgCl\)
\(NaCl+AgNO_3\rightarrow NaNO_3+AgCl\)
\(n_{AgCl}=a+b=0.4\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):\)
\(a=b=0.2\)
\(m_{dd\left(saupư\right)}=26.6+500-57.4=469.2\left(g\right)\)
\(C\%_{KNO_3}=\dfrac{0.2\cdot101}{469.2}\cdot100\%=4.31\%\)
\(C\%_{NaNO_3}=\dfrac{0.2\cdot85}{469.2}\cdot100\%=3.62\%\)
Đúng 2
Bình luận (1)

















