Trong phòng thí nghiệm,bạn An pha được 196g dung dịch axit H2SO4 có nồng độ 20%
a/Tính lượng chất tan H2SO4 có trong dung dịch trênb/Tính lượng nước đã dùng để pha loãng axit trên
Những câu hỏi liên quan
Bạn em đã pha loãng axit bằng cách rót từ từ 20g dung dịch H2SO4 50% vào nước và sau đó thu được 50g dung dịch H2SO4. a) Tính nồng độ phần trăm của dung dịch H2SO4 sau khi pha loãng. b) Tính nồng độ mol của dung dịch H2SO4 sau khi pha loãng biết rằng dung dịch này có khối lượng riêng là 1,1g/cm3.
Đọc tiếp
Bạn em đã pha loãng axit bằng cách rót từ từ 20g dung dịch H2SO4 50% vào nước và sau đó thu được 50g dung dịch H2SO4.
a) Tính nồng độ phần trăm của dung dịch H2SO4 sau khi pha loãng.
b) Tính nồng độ mol của dung dịch H2SO4 sau khi pha loãng biết rằng dung dịch này có khối lượng riêng là 1,1g/cm3.
Pha loãng axit sunfuric đặc bằng cách rót từ từ 20 g dung dịch H2SO4 50% và nước rồi khuấy đều ta thu được 50 g dung dịch H2SO4 A. Tính C% H2SO4 sau khi pha loãng B. Tính khối lượng H2O cần dùng để pha loãng
\(m_{H_2SO_4}=\dfrac{20.50}{100}=10\left(g\right)\)
=> \(C\%\left(dd.sau.khi.pha\right)=\dfrac{10}{50}.100\%=20\%\)
\(m_{H_2O\left(thêm\right)}=50-20=30\left(g\right)\)
Đúng 2
Bình luận (0)
Cho 2,24 lít khí SO3 (đktc) hòa tan vào nước thu được 500ml dung dịch axit sunfuric(H2SO4)
a) Tính nồng độ mol của dung dịch axit H2SO4.
b)Tính khối lượng Zn có thể phản ứng hết với axit có trong dung dịch trên?
a, PTPƯ: SO3 + H2O ---> H2SO4
nSO3=\(\dfrac{2,24}{22,4}=0,1mol\)
1 mol SO3 ---> 0,1 mol H2SO4
nên 0,1 mol SO3 ---> 0,1 mol H2SO4
CM H2SO4=\(\dfrac{0,1}{0,5}\)=0,2 M
b, PTPƯ: Zn + H2SO4 ---> ZnSO4 + H2
1 mol H2SO4 ---> 1 mol Zn
nên 0,1 mol H2SO4 ---> 0,1 mol Zn
mZn=0,1.65=6,5 g
Đúng 1
Bình luận (0)
Có 100ml dung dịch H2SO4 98%, khối lượng riêng là 1,84 g/ml. Người ta muốn pha loãng thể tích H2SO4 trên thành dung dịch H2SO4 20%.
Tính thể tích nước cần dung để pha loãng.
Thể tích nước cần dùng để pha loãng.
Khối lượng của 100ml dung dịch axit 98%
100ml × 1,84 g/ml = 184g
Khối lượng H2SO4 nguyên chất trong 100ml dung dịch trên: 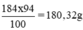
Khối lượng dung dịch axit 20% có chứa 180,32g H2SO4 nguyên chất: 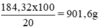
Khối lượng nước cần bổ sung vào 100ml dung dịch H2SO4 98% để có được dung dịch 20%: 901,6g – 184g = 717,6g
Vì D của nước là 1 g/ml nên thể tích nước cần bổ sung là 717,6 ml.
Đúng 1
Bình luận (0)
1.Hãy sử dụng những chất có sẵn Cu, Fe, CuO, KOH, C6H12O6 (glucozơ), dd H2SO4 loãng, H2SO4 đặc và những dụng cụ thí nghiệm cần thiết để làm những thí nghiệm chứng minh rằng: a/ Dd H2SO4 loãng có những tính chất hóa học của axit b/ H2SO4 đặc có những tính chất hóa học riêng Viết phương trình hóa học cho mỗi thí nghiệm 2)Hòa tan hoàn toàn 12,1 gam hỗn hợp bột Cuo Và ZnO cần 100ml dung dịch HCl 3M. a)Viết các phương trình hóa học b) Tính phần trăm theo khối lượng của mỗi oxit trong hỗn hợp ban đầu ...
Đọc tiếp
1.Hãy sử dụng những chất có sẵn Cu, Fe, CuO, KOH, C6H12O6 (glucozơ), dd H2SO4 loãng, H2SO4 đặc và những dụng cụ thí nghiệm cần thiết để làm những thí nghiệm chứng minh rằng:
a/ Dd H2SO4 loãng có những tính chất hóa học của axit
b/ H2SO4 đặc có những tính chất hóa học riêng
Viết phương trình hóa học cho mỗi thí nghiệm
2)Hòa tan hoàn toàn 12,1 gam hỗn hợp bột Cuo Và ZnO cần 100ml dung dịch HCl 3M.
a)Viết các phương trình hóa học
b) Tính phần trăm theo khối lượng của mỗi oxit trong hỗn hợp ban đầu
c) Hãy tính khối lượng dung dịch H2S04 nồng độ 20% để hòa tan hoàn toàn hỗn hợp các oxit trên
1.
a/ - Cho dd H2SO4 loãng t/d với Fe.
Fe + H2SO4 -> FeSO4 + H2O
=> H2SO4 có tính chất hóa học (tchh) của axit: t/d với KL đứng trước H sinh ra muối và khí H2.
- Cho dd H2SO4 l~t/d với CuO.
CuO + H2SO4 -> CuSO4 + H2O
=> H2SO4 có tchh của axit: t/d với oxit bazơ tạo ra muối và nước.
- Cho dd H2SO4 t/d với KOH.
2KOH + H2SO4 -> K2SO4 + 2H2O
=> H2SO4 có tchh của axit: t/d với dd kiềm cho ra muối và nước.
b/ - Cho H2SO4 đặc t/d với Cu.
Cu + 2H2SO4 đ --t*--> CuSO4 + SO2 + 2H2O
=> H2SO4 đặc có tchh riêng: t/d được với Cu, sinh ra khí SO2 (KL đứng sau H).
- Cho H2SO4 đặc t/d với Fe.
2Fe + 6H2SO4 đ --t*--> Fe2(SO4)3 + 6H2O + 3SO2
=> H2SO4 đặc có tchh riêng: t/d với KL sinh ra muối và giải phóng SO2; đẩy được Fe lên hóa trị cao nhất.
- Cho H2SO4 đặc vào C6H12O6.
C6H12O6 ----H2SO4 đ, t*---> 6C + 6H2O
=> H2SO4 đặc có tchh riêng: có tính háo nước.
2. Gọi số mol của CuO và ZnO lần lượt là a và b.
n HCl = Cm.V = 3.0,1 = 0,3 mol.
a/ CuO + 2HCl -> CuCl2 + H2O
_1_____2 (mol)
_a_____2a
ZnO + 2HCl -> ZnCl2 + H2O
_1______2 (mol)
_b_____2b
Theo đề bài, ta có hệ phương trình:
80a + 81b = 12,1 (m hh)
2a + 2b = 0,3 (n HCl)
Giải hệ, được: a = 0,05; b = 0,1.
b/ m CuO = n.M = 80a = 80.0,05 = 4 (g).
=> % mCuO = (mCuO / mhh) . 100% = 33,06 %.
=> % mZnO = 100% - 33,06% = 66,94 %.
c/ CuO + H2SO4 -> CuSO4 + H2O
___1______1 (mol)
___0,05__0,05
ZnO + H2SO4 -> ZnSO4 + H2O
_1_____1 (mol)
_0,1__0,1
Tổng số mol H2SO4 = 0,05 + 0,1 = 0,15 mol.
=> m H2SO4 = n.M = 0,15.98 = 14,7 g.
=> mdd H2SO4 = (mct.100%) / C% = (14,7.100)/20 = 73,5 g.
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 8g CuO vào dung dịch H2SO4 1M. Để trung hòa lượng axit dư trong dung dịch sau phản ứng cần dùng 240ml dung dịch NaOH 0.5M và thu được dung dịch A
a)Thể tích H2SO4 đã dùng?b) Nồng độ mol của các chất trong dung dịch A?
\(n_{CuO}=\dfrac{8}{80}=0.1\left(mol\right)\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(0.1...........0.1.........0.1\)
\(n_{NaOH}=0.24\cdot0.5=0.12\left(mol\right)\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+H_2O\)
\(0.12..........0.06\)
\(n_{H_2SO_4}=0.1+0.06=0.16\left(mol\right)\)
\(V_{dd_{H_2SO_4}}=\dfrac{0.16}{1}=0.16\left(l\right)\)
\(C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0.06}{0.16}=0.375\left(M\right)\)
\(C_{M_{CuSO_4}}=\dfrac{0.1}{0.16}=0.625\left(M\right)\)
Đúng 2
Bình luận (1)
axit H2SO4 100% hấp thụ SO3 tạo ra oleum theo phương trình H2SO4 + SO3 -> H2SO4.nSO3 . Hòa tan 6,76 gam gam oleum vào nước thành 200 ml dung dịch H2SO4 . 10 ml dung dịch trung hòa vừa hết 16 ml dung dịch NaOH 0,5 M a- tính n b- tính hàm lượng % SO3 trong oleum c- cần có bao nhiêu gam oleum có hàm lượng SO3 như trên để pha vào 100 ml dung dịch H2SO4 40% , d= 1,31 g/ml để tạo ra oleum có hàm lượng SO3 là 10%.
H2SO4 + nSO3 => H2SO4.nSO3
H2SO4.nSO3 + nH2O >> n+1H2SO4
H2SO4 + 2NaOH >> Na2SO4 + 2H2O
Số mol NaOH = 0,008 , số mol H2SO4 200ml = 0,008/2 . 200/10 =0,08
Theo (2) nH2SO4.nSO3 =0,08/n+1
MH2SO4.nSO3 =98 +80n = 6,76/0,08/n+1 =84,5n+ 84,5
13,5 =4,5n
=>n=3
%SO3=3.80/2.80+98 =71%
c,Theo câu b , hàm lượng % của SO3 có trong oleum trên là 71
Cứ 100g oleum có 71g SO3 và 29g H2SO4 Khi đó mdd = 1,31.100 = 131g
a g có 71a/100 ...............29a/100
Vì dd H2SO4 có C=40%
Cứ 100g dd có 40g H2SO4 và 60g H2O
=>131g >> 131.40/100 = 52,4g H2SO4 và 131.60/100 = 78,6 g H2O
Khi cho oleum vào dd H2SO4 thì SO3+H2O
SO3 + H2O >> H2SO4
Cứ 80g cần 18g >> 98g
Vậy ..x..g cần 78,6g >>..y..g
x= 78,6.80/18 = 349,3g
y= 78,6.98/18 = 427,9g
Trong loại oleum mới 10% thì mSO3 = 71a/100 -349,3g
và mH2SO4 = 29a/100 +52,4+ 427,9
=> 71a/100 -349,4 / 29a/100 +480,3 = 10/90
=> Bạn ấn máy tìm a nhé
Đúng 1
Bình luận (0)
Cho 200 gam dung dịch NaOH 4% tác dụng vừa đủ với dung dịch axit H2SO4 0,2M. a) Tính thể tích dung dịch axit cần dùng ? b) Biết khối lượng của dung dịch axit trên là 510 gam. Tính nồng độ % của chất có trong dung dịch sau phản ứng?
\(n_{NaOH}=\dfrac{200\cdot4\%}{40}=0.2\left(mol\right)\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+H_2O\)
\(0.2..............0.1..............0.1\)
\(V_{dd_{H_2SO_4}}=\dfrac{0.1}{0.2}=0.5\left(l\right)\)
\(m_{Na_2SO_4}=0.1\cdot142=14.2\left(g\right)\)
\(m_{dd}=200+510=710\left(g\right)\)
\(C\%_{Na_2SO_4}=\dfrac{14.2}{710}\cdot100\%=2\%\)
Đúng 2
Bình luận (1)
Ta có: mNaOH = 200.4% = 8 (g)
\(\Rightarrow n_{NaOH}=\dfrac{8}{40}=0,2\left(mol\right)\)
PT: \(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
_____0,2______0,1_______0,1 (mol)
a, \(V_{ddH_2SO_4}=\dfrac{0,1}{0,2}=0,5\left(l\right)\)
b, Chất có trong dd sau pư là Na2SO4.
Ta có: m dd sau pư = m dd NaOH + m dd H2SO4 = 200 + 510 = 710 (g)
\(\Rightarrow C\%_{Na_2SO_4}=\dfrac{0,1.142}{710}.100\%=2\%\)
Bạn tham khảo nhé!
Đúng 0
Bình luận (0)
\(m_{NaOH}=\dfrac{200.4}{100}=8\left(g\right)\\ n_{NaOH}=\dfrac{8}{40}=0,2\left(mol\right)\)
\(PTHH:2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
a) \(n_{H_2SO_4}=\dfrac{1}{2}n_{NaOH}=\dfrac{1}{2}.0,2=0,1\left(mol\right)\)
\(V_{ddH_2SO_4}=\dfrac{n_{H_2SO_4}}{C_{M_{ddH_2SO_4}}}=\dfrac{0,1}{0,2}=0,5\left(l\right)=500\left(ml\right)\)
b) \(n_{Na_2SO_4}=n_{H_2SO_4}=0,1\left(mol\right)\)
\(m_{Na_2SO_4}=0,1.142=14,2\left(g\right)\)
\(m_{\text{dd sau pư}}=m_{ddNaOH}+m_{ddH_2SO_4}=200+510=710\left(g\right)\)
\(C\%_{Na_2SO_4}=\dfrac{m_{Na_2SO_4}}{m_{\text{dd sau pư}}}.100\%=\dfrac{14,2}{710}.100\%=2\%\)
Đúng 0
Bình luận (0)
Cho 24g SO3 tan hoàn toàn vào nước thu được 500ml dung dịch axit H2SO4
a,viết PTHH
b,tính nồng độ mol của dung dịch
c,tính khối lượng nhôm đủ để phản ứng hết với lượng axit có trong dung dịch
Đổi 500 ml = 0,5 (l)
Số mol SO3 là: 24 : 80 = 0,3 (mol)
SO3 + H2O = H2SO4
0,3 0,3 (mol)
Nồng độ mol dung dịch là : 0,3 : 0,5 = 0,6 (M)
Al + H2SO4 = Al2(SO4)3 + H2
0,3 0,3 (mol)
Khối lượng Al cần tìm là: 27 x 0,3 = 8,1 (g)
Đúng 0
Bình luận (0)























