thể nào là liên kết ion?mô tả sự hình thành liên kết trong họp chất ion
anh em cứu tui

Những câu hỏi liên quan
đơn chất magnesium và đơn chất chlorine phản ứng với nhau tạo thành hợp chất magnesium chloride ,là hợp chất có cấu trúc tinh thể vẽ sơ đồ mô tả sự hình thành liên kết ion trong hợp chất MgCl2 từ các nguyên tử Mg và Cl . Cho biết số proton trong hạt nhân của Mg là 12 và của Cl là 17
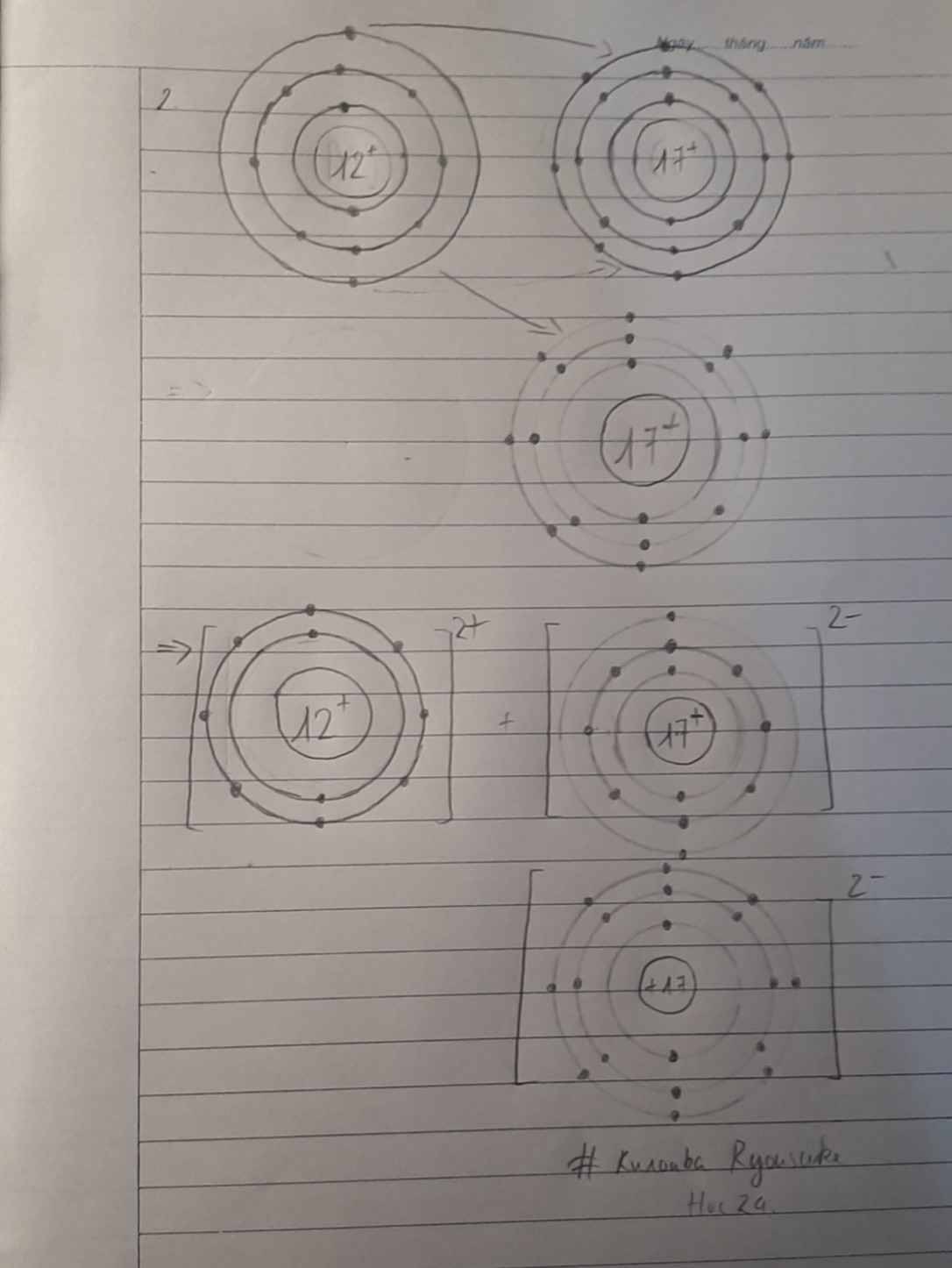
*chỉ vẽ sơ đồ thôi bạn nhỉ?
Đúng 5
Bình luận (7)
Cho sơ đồ mô tả sự hình thành liên kết ion trong phân tử magnesium oxide như sau:
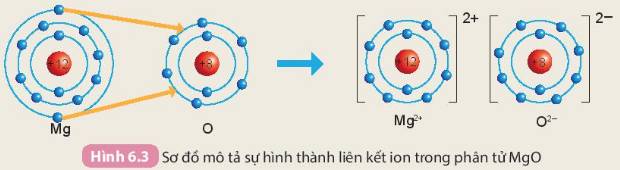
Khi hình thành phân tử `MgO,` các nguyên tử đã có sự nhường nhận `e` như sau:
`-` Nguyên tử `Mg` nhường `2e` ở lớp ngoài cùng cho nguyên tử `O` để tạo thành ion dương \(Mg^{2+}\) có vỏ bền vững giống khí hiếm `Ne`.
`-` Nguyên tử `O` nhận `2e` vào lớp ngoài cùng từ nguyên tử `Mg` để tạo thành ion âm \(O^{2-}\) có vỏ bền vừng giống khí hiếm `Ne`.
Hai ion trái dấu hút nhau, hình thành nên liên kết ion trong phân tử `MgO`.
Đúng 1
Bình luận (0)
cho phân tử NaCl H2 N2 NH3 N2O và CaO tính hiệu độ âm điện viết phương trình mô tả sự hình thành liên kết của các đơn chất ban đầu với phân tử có liên kết với ion
cho phân tử NaCl H2 N2 NH3 N2O và CaO tính hiệu độ âm điện viết phương trình mô tả sự hình thành liên kết của các đơn chất ban đầu với phân tử có liên kết với ion
Viết quá trình cho hoặc nhận electron của các nguyên tử sau: Na, Mg, K, Ca, Al, F, Cl, O, N, S.
- Hãy mô tả sự hình thành liên kết ion từ các nguyên tử tương ứng trong các hợp chất sau: NaF,
Na2O, MgO, MgF2.
- Các hợp chất ion có các đặc điểm gì?
1/ Quá trình nhường - nhận electron.
\(Na^0\rightarrow Na^++e\)
\(Mg^0\rightarrow Mg^{2+}+2e\)
\(Ca^0\rightarrow Ca^{2+}+2e\)
\(F^0+e\rightarrow F^-\)
\(Cl^0+e\rightarrow Cl^-\)
\(O^0+2e\rightarrow O^{2-}\)
\(N^0+3e\rightarrow N^{3-}\)
\(S^0+2e\rightarrow S^{2-}\)
2/ Sự hình thành liên kết ion.
- Trong NaF:
+ Nguyên tử Na nhường 1e.
+ Nguyên tử F nhận 1e.
+ Nguyên tử Na và F tích điện trái dấu nên chúng hút nhau tạo thành phân tử NaF.
- Na2O, MgO, MgF2 giải thích tương tự.
3/ Đặc điểm của các hợp chất ion:
- Các hợp chất ion hầu hết là thể rắn ở nhiệt độ thường, khó tan chảy, khó bay hơi. Chẳng hạn, nhiệt độ nóng chảy của NaCl là 801 oC, nhiệt độ sôi của NaCl là 1465 oC.
- Khi các hợp chất này nóng chảy, hoặc hoà tan trong nước, lực hút tĩnh điện giữa các ion này yếu đi, kết quả là chúng phân li ra các ion trần, nên chúng dẫn điện tốt.
- Ở trạng thái rắn, các hợp chất ion không dẫn được điện.
Đúng 2
Bình luận (0)
Hãy vẽ sơ đồ và mô tả quá trình tạo thành liên kết ion trong phân tử hợp chất magnesium oxide
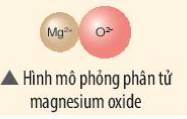
tham khảo
- Nguyên tử Mg (có số hiệu nguyên tử = 12) nhường 2 electron cho O, tạo thành ion Mg2+
- Nguyên tử O (có số hiệu nguyên tử = 8) nhận 2 electron từ Mg, tạo thành ion O2-
=> Ion dương Mg2+ và ion âm O2- mang điện tích trái dấu nên hút nhau, tạo thành liên kết ion
- Sơ đồ mô tả quá trình tạo thành liên kết ion trong phân tử hợp chất magnesium oxide:
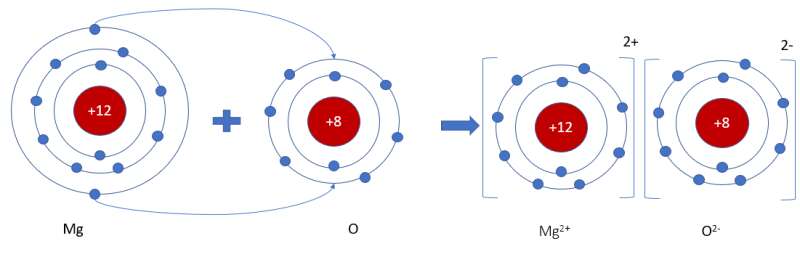
Đúng 1
Bình luận (0)
- Bản chất của liên kết ion ?
- Liên kết ion thưởng gặp giữa loại nguyên tố nào liên kết với nhau? Hình thành bằng cách nào?
- Lấy ví dụ về liên kết ion hình thành bằng cách cho – nhận electron giữa các nguyên tử?
- Lấy ví dụ về liên kết ion được hình thành không phải bằng cách cho nhận electron?
Quan sát Hình 6.4a, em hãy mô tả quá trình tạo thành liên kết ion trong phân tử sodium chloride. Nêu một số ứng dụng của sodium chloride trong đời sống
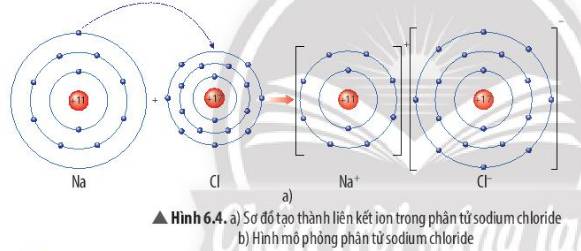
Mô tả quá trình tạo thành liên kết ion trong phân tử sodium chloride:
Khi nguyên tử sodium (Na) kết hợp với nguyên tử chlorine (Cl), nguyên tử Na nhường 1 electron tạo thành ion dương, kí hiệu là Na+, đồng thời nguyên tử Cl nhận 1 electron từ nguyên tử Na tạo thành ion âm, kí hiệu Cl-. Ion Na+ và Cl- hút nhau tạo phân tử sodium chloride (NaCl).
Một số ứng dụng của sodium chloride trong đời sống:
- Trong công nghiệp
+ Trong công nghiệp sản xuất giày da, người ta sử dụng muối để bảo vệ da.
+ Trong sản xuất cao su, muối dùng để làm trắng các loại cao su.
+ Trong dầu khí, muối là thành phần quan trọng trong dung dịch khoan giếng khoan.
+ Từ muối có thể chế ra các loại hóa chất dùng cho các ngành khác như sản xuất nhôm, đồng, thép, điều chế nước Javel,… bằng cách điện phân nóng chảy hoặc điện phân dung dịch NaCl có màng ngăn.
- Trong nông nghiệp, chăn nuôi
+ Muối giúp cân bằng sinh lý trong cơ thể giúp gia súc, gia cầm phát triển khỏe mạnh, giảm bệnh tật.
+ Giúp phân loại hạt giống theo trọng lượng
+ Cung cấp thêm vi lượng khi trộn với các loại phân hữu cơ để tăng hiệu quả của phân bón.
- Trong thực phẩm
+ NaCl dùng trong công nghiệp chế biến thực phẩm. Là thành phẩn chính trong muối ăn và được sử dụng phổ biến.
+ NaCl có tính hút ẩm, do đó được sử dụng để bảo quản thực phẩm, nó làm tăng áp suất thẩm thấu dẫn đến làm cho vi khuẩn bị mất nước và chết.
+ Dùng muối để ướp thực phẩm sống như tôm, cá,… để không bị ươn, ôi trước khi thực phẩm được nấu.
+ Khử mùi thực phẩm, giữ cho trái cây không bị thâm.
+ Tăng hương vị, kiểm soát quá trình lên men của thực phẩm.
- Trong y tế
+ Muối sodium chloride dùng để sát trùng vết thương rất tốt.
+ Dùng để trị cảm lạnh, pha huyết thanh, thuốc tiêu độc và một số loại thuốc khác để chữa bệnh cho con người.
+ Cung cấp muối khoáng cho cơ thể thiếu nước.
+ Muối có tác dụng khử độc, thanh lọc cơ thể, làm đẹp da, chữa viêm họng, làm trắng răng, chữa hôi miệng,…
- Trong đời sống gia đình
+ Giúp rửa sạch ống thoát bồn rửa chén bát
+ Hỗ trợ tẩy vết trắng trên bàn gỗ để lại bởi ly nước và đĩa nóng, lau chùi chảo gang dính mỡ dễ dàng.
+ Gột rửa hết các vết dơ của mồ hôi, vết máu trên quần áo
+ Trị viêm họng
Đúng 0
Bình luận (0)
Mô tả suwjj tạo thành liên kết ion trong các chất sau đây: KCl, AlF3,Al2O3,CaCl2,MgBr2,Na2S, K2O, BaO, Zn3P2













