Quan sát hình 5.2, hãy so sánh về số electron, số lớp electron giữa nguyên tử Na và ion Na+

Quan sát hình 5.5, hãy so sánh về số electron, số lớp electron giữa nguyên tử Mg và ion Mg2+

- Nguyên tử Mg có 12 electron và 3 lớp electron
- Ion Mg2+ có 10 electron và 2 lớp electron
=> Nguyên tử Na đã mất đi 2 electron để tạo thành ion Mg2+
Quan sát Hình 6.2, em hãy mô tả sự tạo thành ion sodium, ion magnesium. Nhận xét về số electron lớp ngoài cùng của các ion này và cho biết sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm nào?
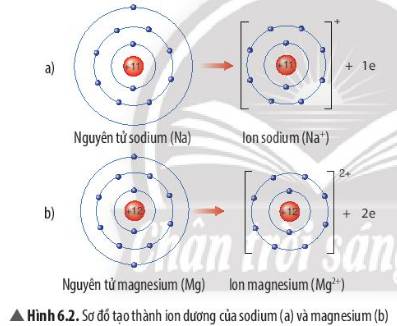
- Sự tạo thành ion sodium: Nguyên tử sodium (Na) cho đi 1 electron lớp ngoài cùng để tạo thành ion dương Na+
- Sự tạo thành ion magnesium: Nguyên tử magnesium (Mg) cho đi 2 electron lớp ngoài cùng để tạo thành ion dương Mg2+
=> Sau khi nhường electron, ion sodium và ion magnesium đều có 2 lớp electron và có 8 electron ở lớp ngoài cùng
=> Sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm Neon (Ne)
Quan sát Hình 6.3, em hãy mô tả sự tạo thành ion chloride, ion oxide. Nhận xét về số electron lớp ngoài cùng của các ion này và cho biết sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm nào?
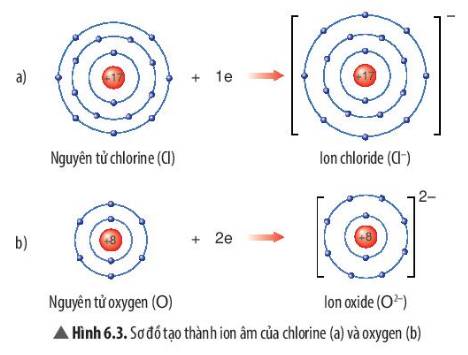
- Sự tạo thành ion chloride: Nguyên tử chlorine (Cl) nhận thêm 1 electron ở lớp ngoài cùng để tạo thành ion âm Cl-
- Sự tạo thành ion oxide: Nguyên tử oxygen (O) nhận thêm 2 electron ở lớp ngoài cùng để tạo thành ion âm O2-
- Sau khi nhận electron, ion chloride có 3 lớp electron và có 8 electron ở lớp ngoài cùng
=> Giống sự phân bố electron của nguyên tử khí hiếm Neon (Ne)
- Sau khi nhận electron, ion oxide có 2 lớp electron và có 8 electron ở lớp ngoài cùng
=> Giống sự phân bố electron của nguyên tử Argon (Ar)
Tìm hiểu mối quan hệ giữa số electron ở lớp ngoài cùng của nguyên tử các nguyên tố với số thứ tự của nhóm
Chuẩn bị: 4 mô hình sắp xếp electron ở vỏ nguyên tử của Li, Na, F, Cl theo mẫu mô tả trong Hình 4.4.
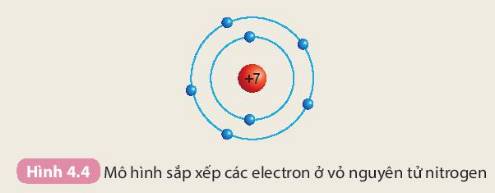
Quan sát các mô hình đã chuẩn bị, thảo luận và trả lời câu hỏi:
1. Hãy cho biết nguyên tử các nguyên tố nào có cùng số electron ở lớp ngoài cùng
2. Hãy so sánh số electron lớp ngoài cùng của nguyên tử các nguyên tố với số thứ tự nhóm của các nguyên tố đó
1:
Nguyên tử Li, Na có cũng số electron ở lớp ngoài cùng
Nguyên tử F, Cl có cũng số electron ở lớp ngoài cùng
2: Số electron lớp ngoài cùng của nguyên tử các nguyên tố chính là số thứ tự nhóm của các nguyên tố
Viết cấu hình electron nguyên tử Na. Cho biết trong bảng tuần hoàn, Na nằm ở ô số 11, chu kì 3, nhóm IA. Nêu mối liên hệ giữa số hiệu nguyên tử, số lớp electron, số electron lớp ngoài cùng và vị trí của Na trong bảng tuần hoàn.
- Cấu hình electron của Na (Z = 11): 1s22s22p63s1
- Trong bảng tuần hoàn, Na nằm ở ô số 11, chu kì 3, nhóm IA.
⟹ Ta thấy:
+ Số hiệu nguyên tử = số thứ tự ô = 11
+ Số lớp electron = số thứ tự chu kì = 3
+ Số electron lớp ngoài cùng = số thứ tự nhóm = 1e
Quan sát hình 5.2 và hình 5.3, cho biết lớp vỏ của các ion Na+, Cl- tương tự vỏ nguyên tử của nguyên tố khí hiếm nào.

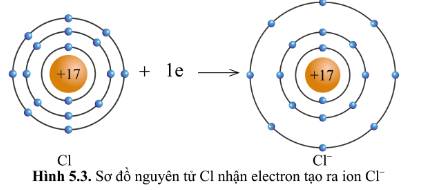
- Xét ion Na+:
+ Có 10 hình cầu màu xanh ở các đường tròn => Có 10 electron ở lớp vỏ
+ Có 2 đường tròn xung quanh hạt nhân => Có 2 lớp electron
=> Lớp vỏ ion Na+ tương tự vỏ nguyên tử của nguyên tố khí hiếm Ne
- Xét ion Cl-
+ Có 18 hình cầu màu xanh ở các đường tròn => Có 18 electron ở lớp vỏ
+ Có 3 đường tròn xung quanh hạt nhân => Có 3 lớp electron
=> Lớp vỏ ion Cl- tương tự vỏ nguyên tử của nguyên tố khí hiếm Ar
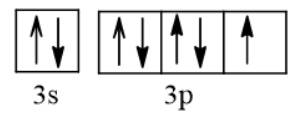
Cấu hình electron của ion được thiết lập bằng cách thêm hoặc bớt electron, bắt đầu từ phân lớp ngoài cùng của cấu hình electron nguyên tử tương ứng. a. Viết cấu hình electron của Na+ và Cl-. b. Nguyên tử Cl nhận 1 electron để trở thành ion Cl-, electron này xếp vào AO thuộc phân lớp nào của Cl? AO đó là AO trống, chứa 1 hay 2 electron?
Cấu hình electron của ion được thiết lập bằng cách thêm hoặc bớt electron, bắt đầu từ phân lớp ngoài cùng của cấu hình electron nguyên tử tương ứng.
a) Viết cấu hình electron của Na+ và Cl-.
b) Nguyên tử Cl nhận 1 electron để trở thành ion Cl-, electron này xếp vào AO thuộc phân lớp nào của Cl? AO đó là AO trống, chứa 1 hay 2 electron?
a) Na (Z = 11) 1s22s22p63s1 ⇒ Na+: 1s22s22p6.
Cl (Z = 17) 1s22s22p63s23p5 ⇒ Cl-: 1s22s22p63s23p6.
b) Nguyên tử Cl nhận 1 electron để trở thành ion Cl-, electron này xếp vào AO thuộc phân lớp p của Cl. AO đó là AO chứa 1 electron.
Quan sát hình ảnh mô tả cấu tạo nguyên tử carbon và nhôm (hình 1.5), hãy cho biết mỗi nguyên tử đó có bao nhiêu lớp electron và số electron trên mỗi lớp electron đó.
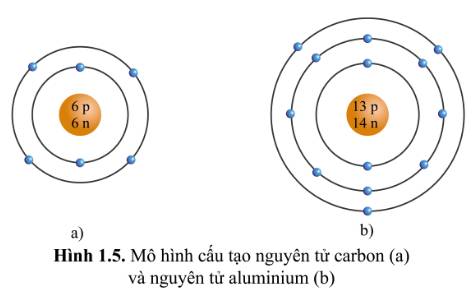
Hình 1.5
a)
-Cấu Tạo nguyên tử Carbon
+nguyên tử Carbon có hai lớp electron
+lớp thứ nhất có 2 electron
+lớp thứ hai có 4 electron
b) -Cấu Tạo nguyên tử Alumunium
+ nguyên tử Alumunium có 3 lớp electron
+ lớp thứ nhất có 2 electron
+ lớp thứ hai có 8 electron
+ lớp thứ ba có 3 electron