Dựa vào Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hoàn toàn 1 mol benzene C6H6(l) trong khí oxygen, tạo thành CO2(g) và H2O(l). So sánh lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g propane C3H8(g) với lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g benzenne C6H6(l).

Những câu hỏi liên quan
Đốt cháy hoàn toàn 1 gam C2H2(g) ở điều kiện chuẩn, thu được CO2(g) và H2O(l), giải phóng 49,98 kJ. Tính biến thiên enthalpy chuẩn của phản ứng đốt cháy 1 mol C2H2.
nC2H2 = 1/26 (mol)
Đốt cháy 1/26 mol C2H2 tỏa ra 49,98 kJ
=> Đốt cháy 1 mol C2H2 tỏa ra x kJ
=> x = 1 x 49,98 : (1/26) = 1299,48 kJ
=> ${\Delta _r}H_{298}^0$ = -1299,48 kJ (vì đây là phản ứng tỏa nhiệt nên enthalpy mang giá trị âm)
Đúng 0
Bình luận (0)
Câu 30: Xét quá trình đốt cháy khí propane C3H8(g):
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
a) Tính biến thiên enthalpy chuẩn của phản ứng dựa vào bảng nhiệt tạo thành của hợp chất và dựa vào dựa vào bảng năng lượng liên kết.
Biết nhiệt tạo thành của C3H8(g); CO2(g) và H2O(g) lần lượt là : 105,00; 393,50 và 241,82 kJ/mol.
Biết EC-H 418 kJ/mol; EC-C 346 kJ/mol; EOO 494 kJ/mol; ECO 732 kJ/mol và EO-H 459 kJ/mol.
b) So sánh hai giá trị đó và nếu có sự khác biệt, hãy giải thích tại sao lại...
Đọc tiếp
Câu 30: Xét quá trình đốt cháy khí propane C3H8(g):
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
a) Tính biến thiên enthalpy chuẩn của phản ứng dựa vào bảng nhiệt tạo thành của hợp chất và dựa vào dựa vào bảng năng lượng liên kết.
Biết nhiệt tạo thành của C3H8(g); CO2(g) và H2O(g) lần lượt là : 105,00; 393,50 và 241,82 kJ/mol.
Biết EC-H = 418 kJ/mol; EC-C = 346 kJ/mol; EO=O = 494 kJ/mol; EC=O = 732 kJ/mol và EO-H = 459 kJ/mol.
b) So sánh hai giá trị đó và nếu có sự khác biệt, hãy giải thích tại sao lại có sự khác biệt đó ?
d) Xác định biến thiên enthalpy chuẩn của phản ứng đốt cháy 1 mol ethane. Biết nhiệt tạo thành
chuẩn của C2H6 (l), CO2 (g) và H2O (l) tương ứng là -84,7 kJ/mol, -393,5 kJ/mol và -285,8
kJ/mol.
\(C_2H_6+\dfrac{7}{2}O_2->2CO_2+3H_2O\\ \Delta_rH^o_{298}=2\left(-393,5\right)+3\left(-285,8\right)-\left(-84,7\right)\\ \Delta_rH^o_{298}=-1559,7kJ\)
Đúng 1
Bình luận (2)
Đốt cháy hoàn toàn 1,00 gam khí C2H2 thu được CO2(k) và H2O(l) giải phóng 50,01 kJ. Tính biến thiên enthalpy của phản ứng đốt cháy 1 mol khí C2H2, từ đó cho biết vì sao C2H2 được sử dụng trong đèn xì hàn cắt kim loại mà không dùng mêtan.
\(\Delta_rH=-\dfrac{50,01kJ}{\dfrac{1}{26}mol}=-1300,26kJ\cdot mol^{-1}\)
Mặt khác, khi đốt 1 mol methane chỉ toả ra lượng nhiệt khoảng 890,2 kJ, thấp hơn nhiều so với acetylene nên acetylene được dùng trong đèn xì.
Đúng 1
Bình luận (0)
Methane là thành phần chính của khí thiên nhiên. Xét phản ứng đốt cháy methane:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ΔrH298
o = -890,3 kJ
Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) tương ứng là –393,5 và –285,8 kJ/mol. Hãy tính
nhiệt tạo thành chuẩn của khí methane.
\(\Delta_fH^{^{ }o}_{298}\left[CH_4\right]=-\left(-890,3-\left(-393,5\right)-\left(-285,8\right)\right)\\ \Delta_fH^{^{ }o}_{298}\left[CH_4\right]=211kJ\cdot mol^{-1}\)
Đúng 1
Bình luận (0)
Pentapeptit X và tetrapeptit Y đều mạch hở. Khi thủy phân hoàn toàn hỗn hợp gồm X và Y chỉ tạo ra một amino axit duy nhất có công thức
H
2
N
C
n
H
2
n
C
O
O
H
. Đốt cháy 0,1 mol Y trong oxi dư, thu được
N
2
và 72,6 gam hỗn hợp gồm
C
O
2...
Đọc tiếp
Pentapeptit X và tetrapeptit Y đều mạch hở. Khi thủy phân hoàn toàn hỗn hợp gồm X và Y chỉ tạo ra một amino axit duy nhất có công thức H 2 N C n H 2 n C O O H . Đốt cháy 0,1 mol Y trong oxi dư, thu được N 2 và 72,6 gam hỗn hợp gồm C O 2 , H 2 O . Đốt cháy 0,01 mol X trong oxi dư, cho sản phẩm cháy vào bình H 2 S O 4 đặc. Kết thúc phản ứng, khối lượng bình tăng m gam so với ban đầu. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 2,43
B. 7,29
C. 9,72
D. 4,86
Chọn đáp án A
● Vì Y chỉ tạo từ H 2 N - C n H 2 n C O O H nên ta quy đổi Y về C 2 H 3 O N , C H 2 v à H 2 O .
n H 2 O = n Y = 0,1 mol
Do Y là tetrapeptit nên n C 2 H 3 N O = 4nY = 0,4 mol.
● Đặt x = n C H 2 .
Bảo toàn C: n C O 2 = 2 * 0,4 + x = x + 0,8
Bảo toàn H: 2 n H 2 O = 3 * 0,4 + 2x + 2 * 0,1 = 2x + 1,4 ⇒ n H 2 O = x + 0,7
Ta có: m C O 2 + m H 2 O = 44 * (x + 0,8) + 18 * (x + 0,7) = 72,6
⇒ x = 0,4 mol.
● Vì n C 2 H 3 N O = n C H 2 = 0,4 mol nên amino axit tạo thành X, Y là H 2 N - C H - C H 3 - C O O H A l a .
Do đó: X là C 3 H 7 N O 2 5 – 4 H 2 O = C 15 H 27 O 6 N 5 .
Cho sản phẩm cháy vào H 2 S O 4 đặc thì chỉ có H 2 O bị hấp thu nên khối lượng bình tăng là do H 2 O gây ra.
Bảo toàn H: n H 2 O = 27 . n X 2 = 0,135 mol
Vậy m = 0,135 * 18 = 2,43 gam.
Đúng 0
Bình luận (0)
Một nhà máy phát điện vận hành bằng các đốt cháy nhiên liệu phức hợp có công thức trung bình là C11H7S. Giả sử nguồn không khí cung cấp chỉ chứa N2 và O2 có tỷ lệ mol 3,76:1,00 và N2 không cho phản ứng. Ngoài nước tạo thành, lượng cacbon trong nhiên liệu được chuyển hóa hoàn toàn thành CO2 và lưu huỳnh chuyển hóa thành SO2. (a) Viết phương trình phản ứng cháy của C11H7S. (b) Để phản ứng cháy xảy ra hoàn toàn, thực tế cần dùng dư 20% lượng oxy so với tỷ lượng lý thuyết. Tính khối lượng (kg) và t...
Đọc tiếp
Một nhà máy phát điện vận hành bằng các đốt cháy nhiên liệu phức hợp có công thức trung bình là C11H7S. Giả sử nguồn không khí cung cấp chỉ chứa N2 và O2 có tỷ lệ mol 3,76:1,00 và N2 không cho phản ứng. Ngoài nước tạo thành, lượng cacbon trong nhiên liệu được chuyển hóa hoàn toàn thành CO2 và lưu huỳnh chuyển hóa thành SO2.
(a) Viết phương trình phản ứng cháy của C11H7S.
(b) Để phản ứng cháy xảy ra hoàn toàn, thực tế cần dùng dư 20% lượng oxy so với tỷ lượng lý thuyết. Tính khối lượng (kg) và thể tích (ở đktc, m3) không khí cần sử dụng để đốt cháy hoàn toàn 1 tấn C11H7S.
(c) Tính tổng khối lượng CO2 và SO2 tạo thành trong điều kiện của câu (b) trên

Do lấy dư 20% oxi so với lượng cần đốt cháy nên lượng oxi đã lấy là:


Tổng khối lượng CO2 và SO2 :
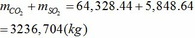
Chú ý:
Lượng O2 lấy dư 20% so với với lượng cần thiết => tính mol O2 chính xác
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 9,2 gam rượu etylic nguyên chất ở nhiệt độ cao. a, Viết phương trình phản ứng xảy ra. b, Tính thể tích khí CO2¬ thu được (ở đktc) và khối lượng H2O tạo thành. c, Dẫn sản phẩm thu được đi qua dung dịch nước vôi trong dư. Tính khối lượng kết tủa CaCO3 thu được sau phản ứng.
a) $C_2H_5OH + 3O_2 \xrightarrow{t^o} 2CO_2 + 3H_2O$
b) $n_{C_2H_5OH} = \dfrac{9,2}{46} = 0,2(mol)$
Theo PTHH :
$n_{CO_2} = 2n_{C_2H_5OH} = 0,4(mol) \Rightarrow V_{CO_2} = 0,4.22,4 = 8,96(lít)$
$n_{H_2O} = 3n_{C_2H_5OH} = 0,6(mol) \Rightarrow m_{H_2O} = 0,6.18 = 10,8(gam)$
c) $CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
$n_{CaCO_3} = n_{CO_2} = 0,4(mol)$
$m_{CaCO_3} = 0,4.100 = 40(gam)$
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 9,96 l (điều kiện tiêu chuẩn ) hỗn hợp khí gồm CH4 và C2H6 trong ko khí thu đc CO2 và H2O bt khối lượng CO2+ 28,6(g) . Hãy tính thành phần % trong mỗi khí ban đầu
Đề bài là 8,96 lít hay 9,96 lít em hầy?
Đúng 0
Bình luận (4)














