Đốt cháy 14,4g chất hữu cơ A cần 5,6gam O2(đktc) thu được nh2o=nco2=2:3 xác định ctpt biết MA

Những câu hỏi liên quan
Đốt cháy hoàn toàn hợp chất hữu cơ A cần dùng 6,72 lít
O
2
(đktc). Sau khi kết thúc phản ứng thu được 13,2 gam
C
O
2
và 5,4 gam
H
2
O
. Xác định CTPT của A biết
d
A
/
H
e
15 A.
C
2
H...
Đọc tiếp
Đốt cháy hoàn toàn hợp chất hữu cơ A cần dùng 6,72 lít O 2 (đktc). Sau khi kết thúc phản ứng thu được 13,2 gam C O 2 và 5,4 gam H 2 O . Xác định CTPT của A biết d A / H e = 15
A. C 2 H 4 O
B. C 2 H 4 O 2
C. C 2 H 4
D. C 4 H 8 O
n C O 2 = 13,2 44 = 0,3 m o l → n C = 0,3 m o l ; m C = 3,6 g a m . n H 2 O = 5,4 18 = 0,3 m o l → n H = 0,6 m o l ; m H = 0,6 g a m .


Vậy A có công thức đơn giản nhất là C H 2 O n .
Lại có M A = 15 . 4 = 60 ( g / m o l ) → n = 2 thỏa mãn.
A là C 2 H 4 O 2 .
⇒ Chọn B.
Đúng 0
Bình luận (0)
Đốt cháy 4,4 gam chất hữu cơ A phải dùng 5,6lít O2 đktc, thu được VCO2 = VH2O. Xác Định CTPT của A, biết dA/kk = 3,04. Giúp em vs ạ
Gọi $n_{CO_2} = n_{H_2O} = a(mol)$
$n_{O_2} = 0,25(mol)$
Bảo toàn khối lượng : $4,4 + 0,25.32 = 44a + 18a \Rightarrow a = 0,2$
Bảo toàn C,H,O :
$n_C = n_{CO_2} = 0,2(mol)$
$n_H = 2n_{H_2O} = 0,4(mol)$
$n_O = 2n_{CO_2} + n_{H_2O} -2n_{O_2} = 0,1(mol)$
Ta có:
$n_C : n_H : n_O = 0,2 : 0,4 : 0,1 = 2 : 4 : 1$
Vậy CTPT của A có dạng $(C_2H_4O)_n$
$M_A = (12.2 + 4 + 16)n = 3,04.29 \Rightarrow n = 2$
Vậy CTPT là $C_4H_8O_2$
Đúng 2
Bình luận (0)
\(n_{O_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Ta có VCO2 = VH2O
\(n_{CO_2}=n_{H_2O}\) (1)
Bảo toàn khối lượng : m hữu cơ + m O2 = m CO2 + m H2O
=> m CO2 + mH2O = 12,4 (2)
Từ (1), (2) => n CO2 = nH2O =0,2 (mol)
=> n C= 0,2 (mol), n H=0,4 (mol)
=> nO = \(\dfrac{4,4-0,2.12-0,4}{16}=0,1\left(mol\right)\)
Gọi CT của hợp chất : CxHyOz
x:y:z = 0,2 : 0,4 : 0,1 = 2:4:1
=> CTĐGN : (C2H4O)n
Ta có : (12.2 + 4 +16).n = 3,04.29
=> n= 2
=> CT : C4H8O2
Đúng 2
Bình luận (0)
Một h/c hữu cơ A có tỉ khối đối vs H2 là 37 . Khi đốt 29,6 g A cần 53,76 lít O2 (đktc) . Thu đc có tỉ lệ nCO2 = 0,8 nH2O. XĐ CTPT của A . Tkanks m.n
Đốt cháy hoàn toàn 6 gam chất hữu cơ A thu được 4,48 gam CO2 ở đktc và 3,6 gam H2O a) xác định CTPT của A biết MA= 60 b) viết CTPT của A biết A có nhóm -COOH HELP ME
Đốt cháy hoàn toàn m gam hợp chất hữu cơ A cần dùng 11,2 gam khí oxi, thu được 8,8 gam
C
O
2
và 5,4 gam
H
2
O
. Xác định CTPT của A biết 25
M
A
35? A.
C
2
H
6
B.
C
2
H
6
O...
Đọc tiếp
Đốt cháy hoàn toàn m gam hợp chất hữu cơ A cần dùng 11,2 gam khí oxi, thu được 8,8 gam C O 2 và 5,4 gam H 2 O . Xác định CTPT của A biết 25 < M A < 35?
A. C 2 H 6
B. C 2 H 6 O
C. C 2 H 4 O
D. C 2 H 4
n C O 2 = 8,8 44 = 0,2 m o l → n C = 0,2 m o l ; m C = 2,4 g a m . n H 2 O = 5,4 18 = 0,3 m o l → n H = 0,6 m o l ; m H = 0,6 g a m .
Bảo toàn khối lượng có: m A + m O 2 = m C O 2 + m H 2 O
→ m A = 8 , 8 + 5 , 4 – 11 , 2 = 3 g a m .
Giả sử trong A có O → m O ( A ) = m A – m C – m H = 3 – 2 , 4 – 0 , 6 = 0 .
Vậy trong A không có Oxi.
Đặt công thức tổng quát của A là C x H y ta có:
x : y = n C : n H = 0 , 2 : 0 , 6 = 1 : 3 .
Vậy A có công thức đơn giản nhất là C H 3 n .
Lại có 25 < M A < 35 → n = 1 thỏa mãn. A là C 2 H 6 .
⇒ Chọn A.
Đúng 0
Bình luận (0)
1.Đốt hoàn toàn 4,2g một este E thu được 6,16g CO2 và 2,52g H2O . Công thức cấu tạo của E là ?2.Este X tạo bởi ancol no đơn chức và axitcacboxylic không no ( có 1 liên kết đôi ) đơn chức . Đốt cháy m mol X thu được 22,4 lít co2 (đktc) và 9g H2O . giá trị của m là bao nhiêu ?3.đốt cháy hoàn toàn 0,1 gam một chất hữu cơ X cần 4,48 lít khí oxi (đktc) thu được nco2:nh2o1:1 . Biết rằng X tác dụng với NAOH tạo ra 2 chất hữu cơ . CTCT của X là ?
Đọc tiếp
1.Đốt hoàn toàn 4,2g một este E thu được 6,16g CO2 và 2,52g H2O . Công thức cấu tạo của E là ?
2.Este X tạo bởi ancol no đơn chức và axitcacboxylic không no ( có 1 liên kết đôi ) đơn chức . Đốt cháy m mol X thu được 22,4 lít co2 (đktc) và 9g H2O . giá trị của m là bao nhiêu ?
3.đốt cháy hoàn toàn 0,1 gam một chất hữu cơ X cần 4,48 lít khí oxi (đktc) thu được nco2:nh2o=1:1 . Biết rằng X tác dụng với NAOH tạo ra 2 chất hữu cơ . CTCT của X là ?
1. CxHyOz + O2 \(\rightarrow\) CO2 + H2O
4,2g m 6,16 2,52
Áp dụng ĐLBTKL: 4,2 + m = 6,16 + 2,52 suy ra: m = 4,48g.
Số mol C: nC = nCO2 = 6,16:44 = 0,14 mol; số mol H: nH = 2nH2O = 2.2,52:18 = 0,28 mol; số mol O: nO = 2nO2 = 2.4,48:32 = 0,28 mol.
x:y:z = 0,14:0,28:0,28 = 1:2:2. Suy ra: CTĐG: (CH2O2)n, công thức này trùng với công thức cấu tạo: HCOOH.
Đúng 0
Bình luận (0)
Câu 2:
Đặt công thức: CnH2n+1COOCmH2m+1
CnH2n-1COOCmH2m+1+(......)O2\(\rightarrow\)(n+1+m)CO2+(n+m)H2O
\(n_{CO_2}=1mol\)
\(n_{H_2O}=0,5mol\)
Dựa theo hệ số cân bằng ta có:
nX=\(n_{CO_2}-n_{H_2O}\)=1-0,5=0,5mol
Đúng 0
Bình luận (0)
Chỗ đặt công thức là CnH2n-1COOCmH2m+1
Mình ghi nhầm thành CnH2n+1
Đúng 0
Bình luận (0)
từ 1 loại tinh dầu người ta tách ra được hợp chất hữu cơ A. Đốt cháy hoàn toàn 2,64g A cần vừa đủ 4,704 lít khí O2(đktc) chỉ thu được CO2 và H2O với tỉ lệ khối lượng là \(\dfrac{mCO2}{mH2O}\) = \(\dfrac{11}{2}\). Biết MA < 150. Xác định công thức phân tử của A
Đốt cháy hoàn toàn m gam hợp chất hữu cơ A cần dùng 11,2 gam khí oxi, thu được 8,8 gam
C
O
2
và 5,4 gam
H
2
O
. Ở đktc 2,24 lít khí A có khối lượng 3 gam. Xác định CTPT của A? A.
C
2
H
6
B.
C
2
H
4
C.
C...
Đọc tiếp
Đốt cháy hoàn toàn m gam hợp chất hữu cơ A cần dùng 11,2 gam khí oxi, thu được 8,8 gam C O 2 và 5,4 gam H 2 O . Ở đktc 2,24 lít khí A có khối lượng 3 gam. Xác định CTPT của A?
A. C 2 H 6
B. C 2 H 4
C. C 3 H 8
D. C 3 H 6
n O 2 = 11,2/32 = 0,35 mol
n C O 2 = 8,8/44 = 0,2 mol ⇒ n C = 0,2 mol
n H 2 O = 5,4/18 = 0,3 mol
⇒ n H = 2.0,3 = 0,6 mol
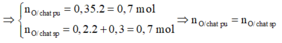
Vậy hợp chất hữu cơ A chỉ có C và H.
Gọi CTTQ của A là C x H y , khi đó ta có:
Vậy CTĐGN của A là C H 3 n
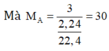
⇒ n = 30/15 = 2
Vậy A là C 2 H 6 .
⇒ Chọn A.
Đúng 0
Bình luận (0)
Anh chị làm ơn giúp e mấy bài này ạ.E cảm ơn!Bài 1:Khi đốt cháy hoàn toàn một lượng hợp chất hữu cơ X cần 0,8 gam O2 người ta thu được 1,1 gam CO2,0,45 gam H2O và không có sản phẩm nào khác. Xác định công thức phân tử của X. Biết rằng khi cho bay hơi hoàn toàn 0,6gam X ở điều kiện nhiệt độ và áp suất thích hợp đã thu được một thể tích hơi đúng bằng thể tích hơi của 0,32 gam O2 trong cùng điều kiện.Bài 2:Đốt cháy hoàn toàn một hợp chất hữu cơ A có thành phần C,H,O thu được CO2 có thể tích bằng 3/...
Đọc tiếp
Anh chị làm ơn giúp e mấy bài này ạ.E cảm ơn!
Bài 1:
Khi đốt cháy hoàn toàn một lượng hợp chất hữu cơ X cần 0,8 gam O2 người ta thu được 1,1 gam CO2,0,45 gam H2O và không có sản phẩm nào khác. Xác định công thức phân tử của X. Biết rằng khi cho bay hơi hoàn toàn 0,6gam X ở điều kiện nhiệt độ và áp suất thích hợp đã thu được một thể tích hơi đúng bằng thể tích hơi của 0,32 gam O2 trong cùng điều kiện.
Bài 2:
Đốt cháy hoàn toàn một hợp chất hữu cơ A có thành phần C,H,O thu được CO2 có thể tích bằng 3/4 thể tích hơi nước và bằng 6/7 thể tích O2 dùng để đốt cháy. Mặt khác, 1l hơi A có khối lượng bằng 46 lần khối lượng 1 lít H2 ở cùng điều kiện.Tìm công thức phân tử của A.
Bài 3: Đốt cháy hoàn toàn 4,3 gam hợp chất hữu cơ thu được 6,72 lít CO2 và 0,35 mol H2O. Khi đốt cháy hoàn toàn 1 mol chất A cần 212,8l O2.Xác định CTPT của A.
Đốt cháy hoàn toàn 7,2g hợp chất hữu cơ A thu đc 10,56g CO2 và 4,32g H2O
a. Xác định CTPT của hợp chất A biết 1 lít hơi A(đktc) nặng 2,679g
b.Biết A là axit hữu cơ.Xác định CTCT đúng của A
\(a,M_A=22,4.2,679=60\left(g\text{/}mol\right)\\ n_C=n_{CO_2}=\dfrac{10,56}{44}=0,24\left(mol\right)\\ n_H=2n_{H_2O}=2.\dfrac{4,32}{18}=0,48\left(mol\right)\\ n_O=\dfrac{7,2-0,24.12-0,48}{16}=0,24\left(mol\right)\)
CTPT của A có dạng: \(C_xH_yO_z\left(x,y,z\in N\text{*}\right)\)
\(\rightarrow x:y:z=0,24:0,48:0,24=1:2:1\\ \rightarrow CTĐGN:\left(CH_2O\right)_n\left(n\in N\text{*}\right)\\ \rightarrow30n=60\\ \rightarrow n=2\left(TM\right)\)
\(CTPT:C_2H_4O_2\)
b, A là axit hữu cớ
\(\rightarrow CTCT:CH_3-COOH\)
Đúng 5
Bình luận (0)





















