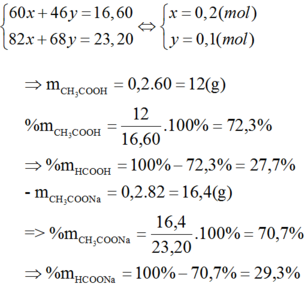Trung hòa 200ml dung dịch axit axetic 1,5M bằng 80g dụng dịch natri hidroxit.
a. Viết phương trình phản ứng
b. Tính nồng độ phần trăm của dung dịch natri hidroxit đã dùng
c. Nếu lấy lượng axit axetic trên đem đun nóng với rượu etylic có axit sunfuric đậm đặc làm xúc tác thì khối lượng este thu được là bao nhiêu gam biết hiệu suất phản ứng là 80%
(giải giúp mình với ạ, mình đang cần gấp để ôn thi cuối kì ạ)