Đốt 4,8g C trong Kk được 6,72l CO2 đktc. Xác định hiệu suất phản ứng

Những câu hỏi liên quan
Đốt cháy hoàn toàn 2,24l hidrocacbon A thể khí thu được 6,72l khí CO2 và 5,4g hơi nước.
1) Xác định công thức phân tử của hidrocacbon, biết rằng thể tích khí đo ở đktc.
2) Tính khối lượng khí Oxi cần dùng cho phản ứng trên.
1) \(n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
=> nC = 0,3 (mol)
\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\)
=> nH = 0,6 (mol)
\(n_A=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Số nguyên tử C = \(\dfrac{0,3}{0,1}=3\) (nguyên tử)
Số nguyên tử H = \(\dfrac{0,6}{0,1}=6\) (nguyên tử)
CTHH: C3H6
2)
PTHH: 2C3H6 + 9O2 --to--> 6CO2 + 6H2O
0,1--->0,45
=> mO2 = 0,45.32 = 14,4 (g)
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 48 gam Cacbon (C) trong 44,8 lít oxi (O2) ở đktc thu được sản phẩm là khí cacbonđioxit ( CO2) a. Xác định chất dư, chất hết trong phản ứng trên.b. Tính khối lượng của sản phẩm thu được sau phản ứng. (Cho C 12, H 1, O 16) giúp tui vs ạ
Đọc tiếp
Đốt cháy hoàn toàn 48 gam Cacbon (C) trong 44,8 lít oxi (O2) ở đktc thu được sản phẩm là khí cacbonđioxit ( CO2)
a. Xác định chất dư, chất hết trong phản ứng trên.
b. Tính khối lượng của sản phẩm thu được sau phản ứng.
(Cho C = 12, H = 1, O = 16)
giúp tui vs ạ
\(a,m_C=48\left(g\right)\rightarrow n_C=\dfrac{m_C}{M_C}=\dfrac{48}{12}=4\left(mol\right)\)
\(V_{O_2}=44,8\left(l\right)\rightarrow n_{O_2}=\dfrac{V_{O_2}}{22,4}=\dfrac{44,8}{22,4}=2\left(mol\right)\)
\(PTHH:C+O_2\underrightarrow{t^o}CO_2\)
\(pt:\) \(1mol\) \(1mol\)
\(đb:\) \(4mol\) \(2mol\)
Xét tỉ lệ:
\(\dfrac{n_{C\left(đb\right)}}{n_{C\left(pt\right)}}=\dfrac{4}{1}=4>\dfrac{n_{O_2\left(đb\right)}}{n_{O_2\left(pt\right)}}=\dfrac{2}{1}=2\)
\(\Rightarrow\) \(O_2\) hết, \(C\) dư.
\(b,PTHH:C+O_2\underrightarrow{t^o}CO_2\)
\(pt:\) \(1mol\) \(1mol\)
\(đb:\) \(2mol\) \(2mol\)
\(\Rightarrow m_{CO_2}=n_{CO_2}.M_{CO_2}=2.\left(1.C+2.O\right)=2.\left(1.12+2.16\right)=88\left(g\right)\)
Đúng 3
Bình luận (0)
\(a.n_C=\dfrac{48}{12}=4\left(mol\right);n_{O_2}=\dfrac{44,8}{22,4}=2\left(mol\right)\\ C+O_2\xrightarrow[t^0]{}CO_2\)
Theo pt:\(\dfrac{4}{1}>\dfrac{2}{1}\Rightarrow C\) dư, O2 pư hết
\(b.C+O_2\xrightarrow[t^0]{}CO_2\\ \Rightarrow n_{CO_2}=n_{O_2}=2mol\\ m_{CO_2}=2.44=88\left(g\right)\)
Đúng 0
Bình luận (0)
Tính hiệu suất phản ứng khi đốt 12 gam carbon trong khí oxygen thu được 39,6 gam, CO2 biết phản ứng xảy ra theo phương trình: C + O2 = CO2
\(n_C=\dfrac{12}{12}=1mol\\ C+O_2\underrightarrow{t^0}CO_2\\ n_{CO_2,lt}=n_C=1mol\\ m_{CO_2,lt}=1.44=44g\\ H=\dfrac{39,6}{44}\cdot100\%=90\%\)
Đúng 0
Bình luận (0)
Thực hiện phản ứng crackinh 11,2 lít hơi isopentan (đktc) thu được hỗn hợp A chỉ gồm các ankan và anken. Trong hỗn hợp A có chứa 7,2 gam một chất X mà khi đốt cháy thì thu được 11,2 lít CO2 (đktc) và 10,8 gam H2O. Hiệu suất phản ứng crackinh isopentan là: A. 80% B. 85% C. 90% D. 95%
Đọc tiếp
Thực hiện phản ứng crackinh 11,2 lít hơi isopentan (đktc) thu được hỗn hợp A chỉ gồm các ankan và anken. Trong hỗn hợp A có chứa 7,2 gam một chất X mà khi đốt cháy thì thu được 11,2 lít CO2 (đktc) và 10,8 gam H2O. Hiệu suất phản ứng crackinh isopentan là:
A. 80%
B. 85%
C. 90%
D. 95%
Đáp án A
Ta có: n C 5 H 12 b a n đ ầ u = 11 , 2 22 , 4 = 0 , 5 m o l
Đốt cháy 7,2g hidrocacbon X trong hỗn hợp A → 11,2 lít CO2 + 10,8 g H2O.
n C O 2 = 11 , 2 22 , 4 = 0 , 5 m o l ; n H 2 O = 10 , 8 18 = 0 , 6 m o l
Ta thấy: n H 2 O > n C O 2 => hidrocacbon X là ankan.
Vì n X = n H 2 O - n C O 2 = 0,6 – 0,5 = 0,1 mol
=> MX = 7 , 2 0 , 1 = 72 <=> 14n + 2 = 72 => n =5
Vậy hidrocacbon X đem đốt là C5H12 và đây cũng chính là lượng C5H12 chưa bị crackinh.
n C 5 H 12 p h ả n ứ n g c r a c k i n h = n C 5 H 12 b a n đ ầ u - n C 5 H 12 c h ư a b ị c r a c k i n h = 0 , 5 - 0 , 1 = 0 , 4 ( m o l ) ⇒ H = 0 , 4 0 , 5 . 100 % = 80 %
= 0,5 – 0,1 = 0,4 (mol)
=> H = . 100% = 80%
Đúng 0
Bình luận (0)
Hỗn hợp X gồm 2 axit cacboxylic mạch hở có công thức: CnH2n-1COOH và CmH2m(COOH)2 và một ancol mạch hở dạng ROH. Đốt cháy hoàn toàn m gam X, thu được 2,688 lít CO2 (đktc) và 2,52 gam H2O. Thực hiện phản ứng este hóa m gam X ( giả sử hiệu suất các phản ứng đều bằng 100%) thu được hỗn hợp, trong đó khối lượng các chất hữu cơ là 3,22 gam và chỉ chứa nhóm chức este. Xác định công thức cấu tạo của các axit và ancol ban đầu.
Đọc tiếp
Hỗn hợp X gồm 2 axit cacboxylic mạch hở có công thức: CnH2n-1COOH và CmH2m(COOH)2 và một ancol mạch hở dạng ROH. Đốt cháy hoàn toàn m gam X, thu được 2,688 lít CO2 (đktc) và 2,52 gam H2O. Thực hiện phản ứng este hóa m gam X ( giả sử hiệu suất các phản ứng đều bằng 100%) thu được hỗn hợp, trong đó khối lượng các chất hữu cơ là 3,22 gam và chỉ chứa nhóm chức este. Xác định công thức cấu tạo của các axit và ancol ban đầu.
nCO2 = 2,688/22,4 = 0,12 mol; nH2O = 2,52/18 = 0,14 mol
Ta thấy nH2O>nCO2 => ancol là ancol no, đơn chức, mạch hở
Gọi công thức chung của ancol là CkH2k+2O (k €N*)
Giả sử:
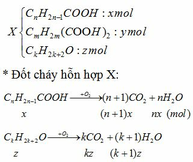
=> nH2O – nCO2 = nx – (n+1)x + (m+1)y – (m+2)y + (k+1)z – kz
=> 0,14 – 0,12 = -x - y + z hay -x - y + z = 0,02 (1)
BTNT ta tính được số mol của các nguyên tố:
nC = nCO2 = 0,12 mol
nH = 2nH2O = 2.0,14 = 0,28 mol
nO = 2nCnH2n-1COOH + 4nCmH2m(COOH)2 + nCkH2k+2O = 2x + 4y + z
=> mX = mC + mH + mO = 0,12.12 + 0,28.1 + 16(2x + 4y + z) = 32x + 64y + 16z + 1,72
* Phản ứng este hóa: Do sau phản ứng chỉ thu được chất có chứa chức este nên axit và ancol phản ứng vừa đủ
n ancol = x + 2y = z hay x + 2y – z = 0 (2)
BTKL ta có: mX = m este + mH2O => 32x + 64y + 16z + 1,72 = 3,22 + 18(x+2y)
hay 14x + 28y + 16z = 1,5 (3)
Từ (1) (2) (3) ta có hệ phương trình:
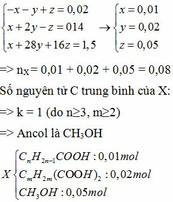
Bảo toàn nguyên tố C ta có: 0,01n + 0,02m + 0,05.1 = 0,12
=> n +2m = 7 mà do n≥3, m≥2 nên chỉ có cặp n = 3, m = 2 thỏa mãn
Vậy các axit trong X là: CH2=CH-COOH và HOOC-COOH.
Kết luận: Hỗn hợp X gồm các chất CH2=CH-COOH, HOOC-COOH và CH3OH.
- Một số ứng dụng của PVC trong thực tế như làm ống dẫn nước, vỏ dây điện, đồ giả da, áo mưa, nhãn chai nước khoáng, …
Đúng 0
Bình luận (0)
Đốt 12g carbon trong oxygen dư thu được 39.6 g carbon dioxide CO2 theo pthh C + O2 suy ra CO2 Tính hiệu suất của phản ứng trên
`#3107.101107`
PTHH: \(\text{ C}+\text{O}_2\) \(\underrightarrow{\text{ }\text{ }\text{ }\text{ }\text{t}^0\text{ }\text{ }\text{ }}\) \(\text{CO}_2\)
Số mol của C là:
\(n_C=\dfrac{m_C}{M_C}=\dfrac{12}{12}=1\left(\text{mol}\right)\)
Theo PT: `1` mol C thu được 1 mol \(\text{CO}_2\)
Vậy, n \(\text{CO}_2\) là 1 mol
m của \(\text{CO}_2\) là:
\(\text{m}_{\text{CO}_2}=\text{n}_{\text{CO}_2}\cdot\text{M}_{\text{CO}_2}=1\cdot44=44\left(\text{g}\right)\)
Hiệu suất của phản ứng trên là:
\(\text{H}=\dfrac{\text{ m}'_{\text{CO}_2}}{\text{m}_{\text{CO}_2}}=\dfrac{39,6}{44}\cdot100=90\%\)
Đúng 1
Bình luận (2)
Cho 11,2lít đktc hỗn hợp X gồm etilen và propilen phản ứng với H2O được hỗn hợp Ancol Y . Chia Y thành 2 phần bằng nhau : Phần 1 phản ứng với Na dư được 2,24lít H2 đktc . Phần 2 đốt cháy hoàn toàn được 22g CO2 . Tìm hiệu suất phản ứng hiđrát hoá các Anken : A. 60% B. 50% C. 75% D. 80%
Đọc tiếp
Cho 11,2lít đktc hỗn hợp X gồm etilen và propilen phản ứng với H2O được hỗn hợp Ancol Y . Chia Y thành 2 phần bằng nhau : Phần 1 phản ứng với Na dư được 2,24lít H2 đktc . Phần 2 đốt cháy hoàn toàn được 22g CO2 . Tìm hiệu suất phản ứng hiđrát hoá các Anken :
A. 60%
B. 50%
C. 75%
D. 80%
Lời giải:
nX = 0,5
phần 1: nX = 0,25
nH2 = 0,1 ⇒ nOH- = 0,2 ⇒ nAncol = 0,2
⇒ H% = (0,2 : 0,25).100% = 80%
Đáp án D.
Đúng 0
Bình luận (0)
A là ancol CmHnOH, B là axit CxHyCOOH (x0). Trộn a gam A với b gam B rồi chia thành 3 phần bằng nhau. Cho phần một phản ứng với Na tạo 3,36 lít khí H2 (đktc). Đốt cháy hoàn toàn phần 2, thu được 39,6 gam CO2. Đun nóng phần 3 với một lít H2SO4 xúc tác, thu được 10,2 gam este với hiệu suất 100%. Đốt cháy hoàn toàn 5,1 gam este tạo ra 11 g CO2 và 4,5 gam H2O. Xác định công thức A, B và giá trị a, b. A. A là CH3OH, B là C3H7COOH. a 6,4; b 8,8. B. A là CH3OH, B là C3H7COOH. a 3,2; b 17,6. C. A...
Đọc tiếp
A là ancol CmHnOH, B là axit CxHyCOOH (x>0). Trộn a gam A với b gam B rồi chia thành 3 phần bằng nhau. Cho phần một phản ứng với Na tạo 3,36 lít khí H2 (đktc). Đốt cháy hoàn toàn phần 2, thu được 39,6 gam CO2. Đun nóng phần 3 với một lít H2SO4 xúc tác, thu được 10,2 gam este với hiệu suất 100%. Đốt cháy hoàn toàn 5,1 gam este tạo ra 11 g CO2 và 4,5 gam H2O. Xác định công thức A, B và giá trị a, b.
A. A là CH3OH, B là C3H7COOH. a = 6,4; b = 8,8.
B. A là CH3OH, B là C3H7COOH. a = 3,2; b = 17,6.
C. A là C2H5OH, B là C2H5COOH. a = 4,6; b = 14,8.
D. A là C2H5OH, B là C2H5COOH. a = 9,2; b = 7,4.
Chọn đáp án B
· Đặt số mol ancol, axit trong mỗi phần lần lượt là z, t.
Phần 1: z + t = 2 n H 2 = 2 . 3 , 36 22 , 4 = 0 , 3 m o l
Phần 2: n C O 2 = m z + ( x + 1 ) t = 39 , 6 44 = 0 , 9 m o l
Phần 3: 5,1 g este + O2 → 0,25 mol CO2 + 0,25 mol H2O
n C O 2 = n H 2 O ⇒ E s t e n o ⇒ Axit và ancol đều no
Áp dụng định luật bảo toàn khối lượng có: m O 2 = 11 + 4 , 5 - 5 , 1 = 10 , 4 g
⇒ n O 2 = 0 , 325 m o l
Áp dụng định luật bảo toàn nguyên tố O có: n e s t e = 2 . 0 , 25 + 0 , 25 - 2 . 0 , 325 2 = 0 , 05 m o l
M e s t e = 5 , 1 0 , 05 = 102 ⇒ ( 14 m + 18 ) + ( 14 x + 46 ) - 18 = 102
⇒ m + x = 4 mà m < x + 1 ⇒ m = 2 , x = 2 hoặc m = 1 , x = 3
Số mol este tạo thành 10 , 2 102 = 0 , 1 m o l ⇒ z ⩾ 0 , 1 t ⩾ 0 , 1
Trường hợp 1: m = 1 , x = 3 ⇒ z + 4 t = 0 , 9
⇒ z = 0 , 1 t = 0 , 2 ⇒ a = 32 . 0 , 1 = 3 , 2 g b = 88 . 0 , 2 = 17 , 6 g
Trường hợp 2: m = 2 , x = 2 ⇐ 2 z + 3 t = 0 , 9
⇒ z = 0 t = 0 , 3 ⇒ Loại
Trường hợp 3: m = 3 , x = 1 ⇒ 3 z + 2 t = 0 , 9
⇒ z = 0 , 3 t = 0 , 2 ⇒ Loại
Đúng 0
Bình luận (0)
hợp chất A gồm 2 nguyên tố và có khối lượng mol là 16g. Đốt cháy 4,8g chất A thì thu được 10,8g nước.
a. Xác định công thức phân tử và viết CTCT của A
b. Tính thể tích không khí (đktc) cần dùng cho phản ứng trên
a) Do đốt cháy A thu được H2O
=> Trong A có H
Gọi CTPT của A là RxHy (x, y nguyên dương)
\(M_{R_xH_y}=16\left(g/mol\right)\)
\(n_{H_2O}=\dfrac{10,8}{18}=0,6\left(mol\right)\)
Bảo toàn H: nH = 1,2 (mol)
=> \(\dfrac{4,8}{16}.y=1,2\)
=> y = 4 (Tm)
\(M_{R_xH_4}=x.M_R+4=16\left(g/mol\right)\)
=> x.MR = 12
- Nếu x = 1 => MR = 12 (Cacbon)
- Nếu x = 2 => Loại
- Nếu x = 3 => Loại
- Nếu x = 4 => Loại
- Nếu x = 5 => Loại
- Nếu x = 6 => Loại
- Nếu x = 7 => Loại
- Nếu x = 8 => Loại
- Nếu x = 9 => Loại
- Nếu x = 10 => Loại
- Nếu x = 11 => Loại
- Nếu x = 12 => Loại
Vậy A là CH4
CTCT
b) \(n_{CH_4}=\dfrac{4,8}{16}=0,3\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,3-->0,6
=> \(V_{O_2}=0,6.22,4=13,44\left(l\right)\)
=> \(V_{kk}=13,44.5=67,2\left(l\right)\)
Đúng 2
Bình luận (0)
















