Cho 10,8 gam kim loại nhôm tác dụng hoàn toàn với dung dịch axit sunfuric loãng (H2SO4). Tính: a. Thể tích hiđro thu được ở đktc? b. Nếu dùng lượng khí Hiđro trên để khử vừa đủ một lượng oxit kim loại X hóa trị II thì thu được 38,4 gam kim loại. Tìm kim loại X.

Những câu hỏi liên quan
Cho 5,4 gam kim loại nhôm tác dụng hoàn toàn với dung dịch axit clohiđric (HCl). Tính: a. Thể tích hiđro thu được ở đktc? b. Nếu dùng lượng khí Hiđro trên để khử vừa đủ một lượng oxit kim loại X hóa trị II thì thu được 19,5 gam kim loại. Tìm kim loại X.
2Al+3H2SO4->Al2(SO4)3+3H2
0,2-----------------------------------0,3
n Al=0,2 mol
=>VH2=0,3.22,4=6,72l
b)
XO+H2-to>X+H2O
0,3-------------0,3
=>0,3=\(\dfrac{19,5}{X}\)
=>X là Zn( kẽm)
Đúng 3
Bình luận (0)
a.\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2 0,3 ( mol )
\(V_{H_2}=0,3.22,4=6,72l\)
b.\(n_X=\dfrac{19,5}{M_X}\)
\(XO+H_2\rightarrow\left(t^o\right)X+H_2O\)
\(\dfrac{19,5}{M_X}\) \(\dfrac{19,5}{M_X}\) ( mol )
Ta có:
\(\dfrac{19,5}{M_X}=0,3\)
\(\Leftrightarrow M_X=65\)
=> X là kẽm (Zn)
Đúng 2
Bình luận (0)
\(a,n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ PTHH:2Al+6HCl\rightarrow AlCl_3+3H_2\uparrow\\ Theo.pt:n_{H_2}=\dfrac{3}{2}n_{Al}=\dfrac{3}{2}.0,2=0,3\left(mol\right)\\ V_{H_2}=0,3.22,4=6,72\left(l\right)\\ b,PTHH:RO+H_2\underrightarrow{t^o}R+H_2O\\ Mol:0,3\leftarrow0,3\rightarrow0,3\\ M_R=\dfrac{19,5}{0,3}=65\left(\dfrac{g}{mol}\right)\\ \Rightarrow R.là.Zn\)
Đúng 2
Bình luận (0)
Xem thêm câu trả lời
Câu 4: Cho 5,4 gam kim loại nhôm tác dụng hoàn toàn với dung dịch axit clohiđric (HCl).
Tính:
a. Thể tích hiđro thu được ở đktc?
b. Nếu dùng lượng khí Hiđro trên để khử vừa đủ một lượng oxit kim loại X hóa trị II thì thu
được 19,5 gam kim loại. Tìm kim loại X.
a.\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,2 0,3 ( mol )
\(V_{H_2}=0,3.22,4=6,72l\)
b.\(XO+H_2\rightarrow\left(t^o\right)X+H_2O\)
\(n_X=\dfrac{19,5}{M_X}\) mol
\(n_{H_2}=n_X=0,3mol\)
\(\Rightarrow\dfrac{19,5}{M_X}=0,3\)
\(M_X=65\) ( g/mol )
=> X là kẽm ( Zn )
Đúng 1
Bình luận (0)
a, nAl = \(\dfrac{5,4}{27}=0,2\left(mol\right)\)
PTHH: 2Al + 6HCl ---> 2AlCl3 + 3H2
0,2 0,6 0,2 0,3
VH2 = 0,3.22,4 = 6,72 (l)
b, PTHH: RO + H2 ---to---> R + H2O
0,3 0,3
=> MR = \(\dfrac{19,5}{0,3}=65\left(\dfrac{g}{mol}\right)\)
=> R là Zn
Đúng 0
Bình luận (0)
Cho 4,8 gam kim loại magie tác dụng hoàn toàn với dung dịch axit HCl. Tính: a. Thể tích hiđro thu được ở đktc? c. Nếu dùng lượng khí Hiđro trên để khử vừa đủ một lượng oxit kim loại R hóa trị II thì thu được 12,8gam kim loại. Tìm kim loại R.
Mg+2HCl->MgCl2+H2
0,2-----------------------0,2
RO+H2-to>R+H2O
0,2-------------0,2
n Mg=\(\dfrac{4,8}{24}\)=0,2 mol
=>VH2=0,2.22,4=4,48l
->0,2=\(\dfrac{12,8}{R}\)
=>R=64 g\mol
=>R là Cu(đồng)
Đúng 2
Bình luận (0)
Trong phòng thí nghiệm, để điều chế khí hiđro người ta cho 9,45 gam kim loại nhôm tác
dụng vừa đủ với dung dịch axit sunfuric loãng H2SO4.
a) Tính khối lượng axit sunfuric cần dùng.
b) Dẫn lượng khí H2 sinh ra ở trên khử hết 36 gam bột đồng (II) oxit CuO, đun nóng. Tính thể tích khí
hiđro cần dùng (ở đktc) để khử hết khối lượng oxit bazơ nói trên?
a.\(n_{Al}=\dfrac{m}{M}=\dfrac{9,45}{27}=0,35mol\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,35 0,525 0,525 ( mol )
\(m_{H_2SO_4}=n.M=0,525.98=51,45g\)
b.\(n_{CuO}=\dfrac{m}{M}=\dfrac{36}{80}=0,45mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,45 < 0,525 ( mol )
0,45 0,45 ( mol )
\(V_{H_2}=n.22,4=0,45.22,4=10,08l\)
Đúng 1
Bình luận (0)
Cho 6 gam kim loại magie tác dụng hoàn toàn với dung dịch axit HCl.
a) Tính thể tích hiđro thu được ở đktc?
b) Tính khối lượng axit HCl phản ứng?
c) Lượng khí hiđro thu được ở trên cho tác dụng với 16 gam sắt (III) oxit. Tính khối lượng sắt thu được sau phản ứng
\(n_{Mg}=\dfrac{6}{24}=0,25\left(mol\right)\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ 0,25.........0,5.........0,25.......0,25\left(mol\right)\\ a.V_{H_2\left(đktc\right)}=0,25.22,4=5,6\left(l\right)\\ b.m_{HCl}=0,5.36,5=18,25\left(g\right)\\ c.n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\\ Fe_2O_3+3H_2\underrightarrow{^{to}}2Fe+3H_2O\\ Vì:\dfrac{0,25}{3}< \dfrac{0,1}{1}\\ \Rightarrow Fe_2O_3dư\\ n_{Fe}=\dfrac{2}{3}.0,25=\dfrac{1}{6}\left(mol\right)\\ \Rightarrow m_{Fe}=\dfrac{1}{6}.56\approx9,333\left(g\right)\)
Đúng 0
Bình luận (0)
a,\(n_{Mg}=\dfrac{6}{24}=0,25\left(mol\right)\)
PTHH: Mg + 2HCl → MgCl2 + H2
Mol: 0,25 0,5 0,25
\(\Rightarrow V_{H_2}=0,25.22,4=5,6\left(l\right)\)
b,\(m_{HCl}=0,5.36,5=18,25\left(g\right)\)
c,\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
PTHH: Fe2O3 + 3H2 → 2Fe + 3H2O
Mol: 0,25 \(\dfrac{1}{6}\)
Ta có: \(\dfrac{0,1}{1}>\dfrac{0,25}{3}\)⇒ Fe2O3 dư, H2 hết
\(m_{Fe}=\dfrac{1}{6}.56=9,33\left(g\right)\)
Đúng 0
Bình luận (0)
\(n_{Mg}=\dfrac{6}{24}=0,25\left(mol\right)\)
Pt : \(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
0,25 0,5 0,25
a) \(n_{H2}=\dfrac{0,25.1}{1}=0,25\left(mol\right)\)
\(V_{H2\left(dktc\right)}0,25.22,4=5,6\left(l\right)\)
b) \(n_{HCl}=\dfrac{0,25.2}{1}=0,5\left(mol\right)\)
⇒ \(m_{HCl}=0,5.36,5=18,25\left(g\right)\)
c) \(n_{Fe2O3}=\dfrac{16}{160}=0,1\left(mol\right)\)
Pt : \(3H_2+Fe_2O_3\rightarrow\left(t_o\right)2Fe+3H_2O|\)
3 1 2 3
0,25 0,1 \(\dfrac{1}{6}\)
Lập tỉ số so sánh : \(\dfrac{0,25}{3}< \dfrac{0,1}{1}\)
⇒ H2 phản ứng hết , Fe2O3 dư
⇒ Tính toán dựa vào số mol của H2
\(n_{Fe}=\dfrac{0,25.2}{3}=\dfrac{1}{6}\left(mol\right)\)
⇒ \(m_{Fe}=\dfrac{1}{6}.56=9,3\left(g\right)\)
Chúc bạn học tốt
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 13 g kẽm vào dung dịch axit clohiđric (HCl) a) tính thể tích khí Hiđro sinh ra (đktc) b) nếu dùng toàn bộ lượng Hidro ở trên để khử 14,4 g một oxit kim loại R thì vừa đủ và thu được 0,2 mol kim loại. Tìm R và công thức hóa học của hợp chất oxit.
Zn+2HCl->Zncl2+H2
0,2--------------------0,2
2RO+H2-to>2R+H2O
0,2 0,2
n Zn=\(\dfrac{13}{65}\)=0,2 mol
=>VH2=0,2.22,4=4,48l
=>\(\dfrac{14,4}{R+16}\)=0,2
=>R=56
R là sắt (Fe)
->CTHH :FeO
'
Đúng 2
Bình luận (0)
Cho 16,8 gam kim loại Fe tác dụng hoàn toàn với dung dịch axit clohiđric (HCl). Tính:
a. Thể tích hiđro thu được ở đktc và khối lượng axit HCl cần đưa vào phản ứng.
b. Lượng khí hiđro thu được ở trên cho tác dụng với 32 gam đồng (II) oxit nung nóng. Tính khối lượng Cu thu được sau phản ứng?
a, \(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
PTHH: Fe + 2HCl ---to---> FeCl2 + H2
Mol: 0,3 0,6 0,3
\(V_{H_2}=0,3.22,4=6,72\left(l\right)\)
\(m_{HCl}=0,6.36,5=21,9\left(g\right)\)
b, \(n_{CuO}=\dfrac{32}{80}=0,4\left(mol\right)\)
PTHH: H2 + CuO ---to---> Cu + H2O
Mol: 0,3 0,3
Ta có: \(\dfrac{0,3}{1}< \dfrac{0,4}{1}\) ⇒ H2 pứ hết, CuO dư
\(m_{Cu}=0,3.64=19,2\left(g\right)\)
Đúng 3
Bình luận (0)
Hoà tan hoàn toàn 13g kẽm vào dung dịch axitclohiđric (HCl). a) Tìm thể tích khí hiđro sinh ra (đktc) b) Nếu dùng toàn bộ lượng hiđro ở trên để khử 14,4g một oxi kim loại R thì vừa đủ và thu được 0,1 mol kim loại. Tìm R và CTHH của h/c oxit
a) \(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: 0,2 0,2
\(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
Đúng 1
Bình luận (2)
Cho các kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng. a) Viết các phương trình phản ứng. b) Cho cùng một khối lượng các kim loại trên tác dụng hết với axit sunfuric? Kim loại nào cho nhiều khi hiđro nhất? c) Nếu thu được cùng một thể tích khí hiđro thì khối lượng kim loại nào nhỏ nhất?
Đọc tiếp
Cho các kim loại kẽm, nhôm, sắt lần lượt tác dụng với dung dịch axit sunfuric loãng.
a) Viết các phương trình phản ứng.
b) Cho cùng một khối lượng các kim loại trên tác dụng hết với axit sunfuric? Kim loại nào cho nhiều khi hiđro nhất?
c) Nếu thu được cùng một thể tích khí hiđro thì khối lượng kim loại nào nhỏ nhất?
a) Phương trình phản ứng:
Zn + H2SO4 → ZnSO4 + H2
Fe + H2SO4loãng → FeSO4 + H2
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2
b) Giả sử cho cùng một khối lượng là a g kim loại kẽm sắt và nhôm
Zn + H2SO4 → ZnSO4 + H2 (1)
Fe + H2SO4loãng → FeSO4 + H2 (2)
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2 (3)
Ta có 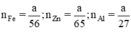
Theo pt nH2 (1) = nZn = 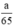 mol
mol
nH2 (2) = nFe = 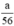 mol
mol
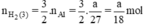
Như vậy ta nhận thấy 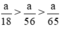 ⇒ nH2 (3) > nH2 (2) > nH2 (1)
⇒ nH2 (3) > nH2 (2) > nH2 (1)
Như vậy cho cùng một lượng kim loại tác dụng với axit H2SO4 loãng dư thì nhôm cho nhiều khí hidro hơn, sau đó đến sắt và ít nhất là kẽm
c) Nếu thu được cùng một lượng khí hidro thì khối lượng kim loại ít nhất là nhôm, sau đó đến sắt, cuối cùng là kẽm.
Đúng 1
Bình luận (0)




















