Có thể điều chế khí hiđro từ các chất gì?

Những câu hỏi liên quan
Có thể điều chế khí hiđro từ các chất gì?
Trong phòng thí nghiệm :
\(Chất\ rắn :Al,Mg,Zn,Fe,...\\ Dung\ dịch : HCl,H_2SO_4\ loãng,...\\ Mg+ 2HCl \to MgCl_2 + H_2\\ Zn + H_2SO_4 \to ZnSO_4 + H_2\\ Fe + 2HCl \to FeCl_2 + H_2\)
Trong công nghiệp :
\(2H_2O \xrightarrow{đp} 2H_2 + O_2\)
Đúng 4
Bình luận (0)
– Trong phòng thí nghiệm, người ta điều chế khí hidro bằng cách cho axit (HCl, H2SO4 loãng,…) tác dụng với kim loại (Zn, Fe, Al,…).
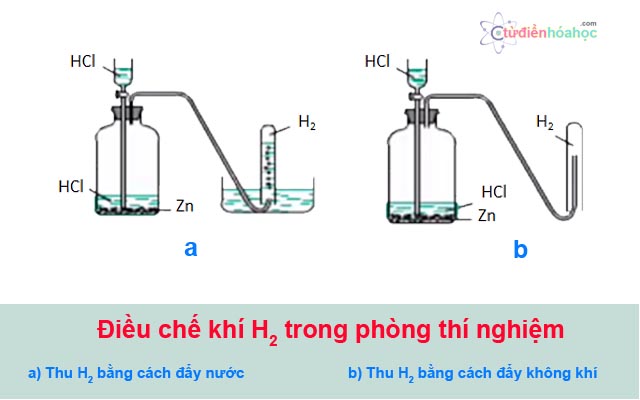
phuong-phap-dieu-che-khi-hidro-trong-phong-thi-nghiem
Một số ứng điều chế khí H2 trong phòng thí nghiệm:
Zn + 2HCl → ZnCl2 + H2
Fe + 2HCl → FeCl2 + H2
2Al + 6HCl → 2AlCl3 + 3H2
Fe + H2SO4 → FeSO4 + H2
2. Điều chế khí hidro trong công nghiệpTrong công nghiệp, những phương pháp điều chế khí hidro là:
Điện phân nướcDùng than khử oxi của H2O trong lò khí thanĐiều chế từ khí tự nhiên, khí dầu mỏĐiều chế khí hidro từ điện phân nước
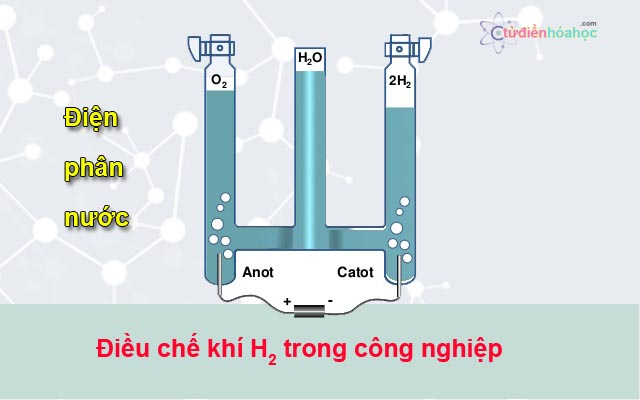
phuong-phap-dieu-che-khi-hidro-trong-phong-cong-nghiep
3. Phản ứng thế là gì?Định nghĩa: Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.
Ví dụ:
Zn + H2SO4 → ZnSO4 + H2 ↑
Fe + 2HCl → FeCl2 + H2 ↑
Bài tập về điều chế khí Hiđro và phản ứng thếCâu 1. Những PTHH nào dùng để điều chế khí hidro trong PTN?
a) Zn + H2SO4 → ZnSO4 + H2
b) 2H2O(điện phân)→ 2H2 + O2
c) 2Al + 6HCl → 2AlCl3 + 3H2
Trả lời:
PTHH dùng để điều chế khí H2 trong PTN là (a) và (c)PTHH dùng để điều chế khí H2 trong công nghiệp là: (b)Câu 2. Lập PTHH của các sơ đồ phản ứng sau và cho biết chúng thuộc loại PƯHH nào?
a) Mg + O2 —> MgO
b) KMnO4 —> K2MnO4 + MnO2 + O2
c) Fe + CuCl2 —> FeCl2 + Cu
Trả lời:
a) 2Mg + O2 → 2MgO ⇒ Phản ứng hóa hợp, phản ứng oxi hóa khử.
b) 2KMnO4 → K2MnO4 + MnO2 + O2⇒ Phản ứng phân hủy.
c) Fe + CuCl2 → FeCl2 + Cu ⇒ Phản ứng thế.
Câu 3. Khi thu khí O2 vào ống nghiệm bằng cách đẩy không khí, phải để ống nghiệm như thế nào? Đối với khí hidro có làm thế được không? Tại sao?
Trả lời:
Để thu khí O2 vào ống nghiệm bằng cách đẩy không khí, người ta thường để ống nghiệm đứng vì khí O2 nặng hơn không khí. Với khí H2, người ta thu nó bằng cách để úp ống nghiệm để đẩy không khí vì khí H2 nhẹ hơn không khí.
Câu 4. Trong PTN có các kim loại Zn, Fe, dd axit HCl và dung dịch axit H2SO4 loãng:
a) Viết các PTHH có thể điều chế H2.
b) Phải dùng bao nhiêu gam Zn, Fe để điều chế được 2,24 lít khí H2 (đktc).
Trả lời:
a) Các PTHH có thể điều chế H2:
Zn + 2HCl → ZnCl2 + H2 (1)
Zn + H2SO4 → ZnSO4 + H2 (2)
Fe + 2HCl → FeCl2 + H2 (3)
Fe + H2SO4 → FeSO4 + H2 (4)
b) Theo đề bài, ta có:
– Số mol khí H2 là:
nH2 = V/22,4 = 2,24/22,4 = 0,1 (mol)
– Theo các PTHH, ta thấy: nH2 = nZn = nFe = 0,1 (mol)
Số gam Zn cần dùng ở thí nghiệm (1) và (2) là:mZn =0,1 x 65 = 6,5 (gam)
Số gam Fe cần dùng ở thí nghiệm (3) và (4) là:mFe =0,1 x 56 = 5,6 (gam)
Câu 5. Cho 22,4 gam Fe tác dụng với dd loãng có chứa 24,5 gam axit sunfuric H2SO4.
a) Chất nào còn dư sau phản ứng và dư bao nhiêu gam?
b) Tính thể tích khí H2 thu được (đktc).
Trả lời:
a) Ta có PTHH của phản ứng:
Fe + H2SO4 → FeSO4 + H2
– Số mol Fe và H2SO4 là:
nFe = 22,4/56 = 0,4 (mol)
nH2SO4 = 24,5/98 = 0,25 (mol)
– Theo phương trình hóa học:
Cứ 1 mol H2SO4tham gia phản ứng với 1 mol FeVậy 0,25 mol H2SO4tham gia phản ứng với 0,25 mol Fe⇒ nFe (dư) = 0,4 – 0,25 = 0,15 (mol)
⇒ mFe (dư) =0,15 x 56 = 8,4 (gam)
b) Theo PTHH, ta có:
nH2 = nH2SO4 = 0,25 (mol)
Thể tích khí H2 thu được (đktc) là:
VH2 = nH2 x 22,4 = 0,25 x 22,4 = 5,6 (lít)
Lời kết
Vậy là chúng ta vừa tìm hiểu xong cách điều chế khí hidro trong phòng thí nghiệm và trong công nghiệp. Bên cạnh đó là khái niệm về phản ứng thế. Chúc các bạn luôn học tốt và đam mê hóa học nhé!
Đánh giá bài viết
Đúng 0
Bình luận (0)
Ây dà, thanh niên cop mạng lại xuất hiện rồi~ =)))
Đúng 3
Bình luận (2)
Xem thêm câu trả lời
Cho dung dịch axit sunfuric loãng, nhôm và các dụng cu thí nghiệm như hình vẽ. Hãy chọn câu trả lời đúng trong các câu sau: A. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu khí oxi. B. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu không khí. C. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu khí hiđro. D. Có thể dùng để điều chế hidro nhưng không thu được khí hiđro.
Đọc tiếp
Cho dung dịch axit sunfuric loãng, nhôm và các dụng cu thí nghiệm như hình vẽ. Hãy chọn câu trả lời đúng trong các câu sau:
A. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu khí oxi.
B. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu không khí.
C. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu khí hiđro.
D. Có thể dùng để điều chế hidro nhưng không thu được khí hiđro.
Câu trả lời đúng là C.
PT: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Từ phản ứng này ⇒ có thể điều chế khí H2
Khí H2 nhẹ hơn không khí nên úp ngược ống nghiệm sẽ thu được khí H2
Đúng 0
Bình luận (0)
Câu 11: Cho các chất sau đây: KOH, Al, (NH4)2SO4 , CaCO3 , NH4HSO3 , H2SO4 , NaCl , FeS
a- Từ các chất trên có thể điều chế được những khí gì?
b- Làm thế nào để nhận biết được các khí đó.
\(a.-KhíH_2:\\ 2KOH+2Al+2H_2O\rightarrow2KAlO_2+3H_2\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ -KhíNH_3\\ 2KOH+\left(NH_4\right)_2SO_4\rightarrow K_2SO_4+2NH_3+2H_2O\\2 KOH+NH_4HSO_3\rightarrow K_2SO_3+NH_3+2H_2O\\ -KhíCO_2:\\ H_2SO_4+CaCO_3\rightarrow CaSO_4+H_2O+CO_2\\-KhíH_2S:\\ FeS+H_2SO_4\rightarrow FeSO_4+H_2S\\ -KhiSO_2\\ 2NH_4HSO_3+H_2SO_4\rightarrow\left(NH_4\right)_2SO_4+2SO_2+2H_2O\)
b. Để nhận biết các khí : \(H_2,NH_3,H_2S,SO_2\)
+ Khí nào có mùi trứng thối là H2S
+ Khí nào có mùi khai là NH3
+ Khí nào có mùi hắc là SO2
+ Khí không mùi là H2
Đúng 1
Bình luận (0)
Các chất khí điều chế trong phòng thí nghiệm thường được thu theo phương pháp đẩy không khí (cách 1, cách 2) hoặc đẩy nước (cách 3, cách 4) như các hình vẽ dưới đây: Trong phòng thí nghiệm, có thể điều chế khí hiđro clorua bằng cách cho tinh thể NaCl tác dụng với axit
H
2
S
O
4
đậm đặc và đun nóng: Dùng cách nào trong bốn cách trên để thu khí HCl? A. Cách 1 B. Cách 2 C. Cách 3 D. Các...
Đọc tiếp
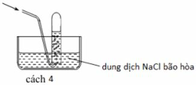
Các chất khí điều chế trong phòng thí nghiệm thường được thu theo phương pháp đẩy không khí (cách 1, cách 2) hoặc đẩy nước (cách 3, cách 4) như các hình vẽ dưới đây:
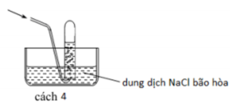
Trong phòng thí nghiệm, có thể điều chế khí hiđro clorua bằng cách cho tinh thể NaCl tác dụng với axit H 2 S O 4 đậm đặc và đun nóng:
![]()
![]()
Dùng cách nào trong bốn cách trên để thu khí HCl?
A. Cách 1
B. Cách 2
C. Cách 3
D. Cách 4
Baì 6: Trong PTN có thể điều chế khí hiđro bằng cách cho các kim loại : Sắt, Kẽm , Nhôm phản ứng với dd axit Clohidric. a-Nếu lấy cùng một khối lượng mỗi kim loại trên thì khí hiđro điều chế được với kim loaị nào là nhiều nhất.? b-Nếu muốn điều chế cùng một lượng khí hiđro thì dùng kim loại nào tiết kiệm kim loại nhất?
Fe + 2HCl → FeCl2 + H2
Zn + 2HCl → ZnCl2 + H2
2Al + 6HCl → 2AlCl3 + 3H2
a) Đặt khối lượng của ba kim loại là 1 gam
→ nFe = 1/56 mol, nZn = 1/65 mol, nAl = 1/27 mol
→ Số mol H2 do sắt tạo thành: nH2 (1) = 1/56 mol
Số mol H2 do kẽm tạo thành: nH2 (2) = 1/65 mol
Số mol H2 do nhôm tạo thành: nH2 (3) = 1/18 mol
→ Số mol H2 (2) < (1) < (3)
→ Nếu lấy cùng khối lượng mỗi kim loại trên thì nhôm có thể tạo ra nhiều khí nhất.
b) Đặt số mol khí H2 tạo thành là 1 mol
→ nFe = 1 mol → m Fe = 56 gam
nZn = 1 mol → mZn = 65 gam
nAl = 2/3 mol → mAl = 18 gam
→ Để tạo thành được 1 mol khí H2 thì dùng Al sẽ tốn ít kim loại nhất
Đúng 0
Bình luận (0)
Cần điều chế 33,6g sắt bằng cách dùng khí hiđro khử sắt từ oxit a.tính khối lượng sắt từ oxit cần dùng? b. Tính thể tích khí hiđro đã dùng(đktc)? c. Để có được lượng khí hiđro trên, cần phải điện phân bao nhiêu gam nước?
`4H_2 + Fe_3 O_4` $\xrightarrow{t^o}$ `3Fe + 4H_2 O`
`n_{Fe} = (33,6)/56 = 0,6 (mol)`
`a.`
Theo phương trình: `n_{Fe_3 O_4} = 1/3n_{Fe} = 0,2 (mol)`
`-> m_{Fe_3 O_4} = 0,2 . 232 = 46,4 (g)`
`b.`
Theo phương trình: `n_{H_2} = 4/3n_{Fe} = 0,8 (mol)`
`-> V_{H_2} = 0,8 . 22,4 = 17,92 (l)`
`c.`
`2H_2 O` $\xrightarrow{\text{điện phân}}$ `2H_2 + O_2`
Theo phương trình: `n_{H_2 O} = H_2 = 0,8 (mol)`
`-> m_{H_2 O} = 0,8 . 18 = 14,4 (g)`
Đúng 1
Bình luận (0)
a) Khối lượng Fe3O4 cần dùng để điều chế 33,6 g Fe:
232 x 0,2 = 46,4 (g)
b) Thể tích khí cần dùng: 0,8 x 22,4 =17,92 (lít).
Đúng 0
Bình luận (0)
Viết các phương trình hoá học của phản ứng điều chế khí hiđro từ những chất sau : Zn, dung dịch HCl, dung dịch H 2 SO 4
Các phương trình hoá học điều chế khí hiđro :
Zn + 2HCl → ZnCl 2 + H2 ↑(1)
Zn + H 2 SO 4 → ZnSO 4 + H2 ↑(2)
Đúng 0
Bình luận (0)
Các chất khí điều chế trong phòng thí nghiệm thường được thu theo phương pháp đẩy không khí (cách 1, cách 2) hoặc đẩy nước (cách 3, cách 4) như các hình vẽ dưới đây: Trong phòng thí nghiệm, có thể điều chế khí hiđro clorua bằng cách cho tinh thể NaCl tác dụng với axit
H
2
S
O
4
đậm đặc và đun nóng: NaOH+
H
2
S
O
4...
Đọc tiếp
Các chất khí điều chế trong phòng thí nghiệm thường được thu theo phương pháp đẩy không khí (cách 1, cách 2) hoặc đẩy nước (cách 3, cách 4) như các hình vẽ dưới đây:
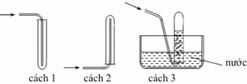
Trong phòng thí nghiệm, có thể điều chế khí hiđro clorua bằng cách cho tinh thể NaCl tác dụng với axit H 2 S O 4 đậm đặc và đun nóng:
NaOH+ H 2 S O 4 đ ặ c → t ∘ N a H S O 4 +HCl
Dùng cách nào trong bốn cách trên để thu khí HCl?
A. Cách 1
B. Cách 2
C. Cách 3
D. Cách 4
Trong phòng thí nghiệm khí õi đc điều điều chế từ kalipemanganat hãy tính khối lượng kalipemanganat cần dùng điều chế thể tích khí oxiđu để đốt cháy hết 4,48 lít khí hiđro(đktc)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH:
\(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\\
2H_2+O_2\xrightarrow[]{t^o}2H_2O\)
Theo PTHH: \(n_{KMnO_4}=2n_{O_2}=2.\dfrac{1}{2}n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{KMnO_4}=0,2.158=31,6\left(g\right)\)
Đúng 3
Bình luận (0)




















