Cho 1,53g X gồm Mg; Fe; Zn và Al phản ứng hoàn toàn với dung dịch HCl dư thấy tạo ra 448ml khí H2 đktc. Khối lượng muối clorua tạo ra sau phản ứng là

Những câu hỏi liên quan
Cho 1,53g hỗn hợp Mg, Fe, Zn vào dd HCl dư thấy thoát ra 448ml khí (đktc). Cô cạn hỗn hợp sau phản ứng thì thu được chất rắn có khối lượng là
nH2=0,44822,4=0,02mol
BTNTH:nHClpư=2nH2=0,04mol
BTKL:mKL+mHClpư=mmuối+mH2
=>1,53+0,04.36,5=mmuối+0,02.2
=>mmuối=2,95gam
Chất rắn sau khi cô cạn là muối có khối lượng 2,95 gam.
Cho 1,53g hỗn hợp bột Mg, Zn và Fe với dung dịch HCl dư thấy thoát ra 4,48ml khí (đktc). Cô cạn hỗn hợp sau phản ứng thì thu được chất rắn có khối lượng là.
\(n_{H2}=\frac{0,00448}{22,4}=0,0002\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
Zn + 2HCl --> ZnCl2 + H2
Fe + 2HCl --> FeCl2 + H2
Theo PTHH => nHCl = 2nH2
=> nHCl = 2.0,0002=0,0004(mol)
=> mHCl = 0,0004.36,5=0,0146(g)
mH2 = 0,0002.2=0,0004(g)
=> mhh = 1,53 + 0,0146 - 0,0004 = 1,5442(g) theo ĐLBTKL
Cách khác :
Đổi : \(4,48\left(ml\right)=4,48.10^{-3}\)
\(\Rightarrow n_{H2}=4,48.10^{-3}:22,4=2.10^{-4}\)
\(\Rightarrow n_{HCl}=2n_{H2}=2.10^{-4}.2=4.10^{-4}\)
Bảo toàn khối lượng
mhh + mHCl = m muối + mH2
\(1,53+4.10^{-4}.36,5=m_{muoi}+2.10^{-4}.2\)
\(\Rightarrow m_{muoi}=1,5442\left(g\right)\)
Vậy chất rắn sau khi cô cạn là khối lượng muối là 1,5442 g
Cho 7,6g hỗn hợp X gồm Mg và Ca phản ứng vừa đủ với 4,48 lit hỗn hợp khí Y ( dktc) gồm Cl2 và O2 thu được 19,85g chất rắn Z chỉ gồm các muối clorua và các oxit kim loại . Khối lượng của Mg trong 7,6g X là : A. 2,4g B. 4,6g C. 3,6g D. 1,8g
Đọc tiếp
Cho 7,6g hỗn hợp X gồm Mg và Ca phản ứng vừa đủ với 4,48 lit hỗn hợp khí Y ( dktc) gồm Cl2 và O2 thu được 19,85g chất rắn Z chỉ gồm các muối clorua và các oxit kim loại . Khối lượng của Mg trong 7,6g X là :
A. 2,4g
B. 4,6g
C. 3,6g
D. 1,8g
Đáp án : C
Gọi số mol Cl2 và O2 là x và y mol
=> mY = 71x + 32y = mZ – mX = 12,25g
Và nY = x + y = 0,2 mol
=> x = 0,15 ; y = 0,05 mol
Gọi số mol Mg và Ca là a và b mol
=> Bảo toàn e : 2a + 2b = 2x + 4y = 0,5 mol
Và mX = 24a + 40b = 7,6g
=> a = 0,15 mol => mMg = 3,6g
Đúng 0
Bình luận (0)
Cho 7,6g hỗn hợp X gồm Mg và Ca phản ứng vừa đủ với 4,48 lit hỗn hợp khí Y ( dktc) gồm Cl2 và O2 thu được 19,85g chất rắn Z chỉ gồm các muối clorua và các oxit kim loại . Khối lượng của Mg trong 7,6g X là : A. 2,4g B. 4,6g C. 3,6g D. 1,8g
Đọc tiếp
Cho 7,6g hỗn hợp X gồm Mg và Ca phản ứng vừa đủ với 4,48 lit hỗn hợp khí Y ( dktc) gồm Cl2 và O2 thu được 19,85g chất rắn Z chỉ gồm các muối clorua và các oxit kim loại . Khối lượng của Mg trong 7,6g X là :
A. 2,4g
B. 4,6g
C. 3,6g
D. 1,8g
Đáp án C
Gọi số mol Cl2 và O2 là x và y mol
=> mY = 71x + 32y = mZ – mX = 12,25g
Và nY = x + y = 0,2 mol
=> x = 0,15 ; y = 0,05 mol
Gọi số mol Mg và Ca là a và b mol
=> Bảo toàn e : 2a + 2b = 2x + 4y = 0,5 mol
Và mX = 24a + 40b = 7,6g
=> a = 0,15 mol => mMg = 3,6g
Đúng 0
Bình luận (0)
Cho hỗn hợp gồm Al, Mg, Al(OH)3, Al2O3, MgO vào dung dịch NaOH dư còn lại rắn X. X gồm A. Mg, MgO B. Al2O3, Al, Al(OH)3 C. Al, Mg D. Al(OH)3, Al2O3, MgO
Đọc tiếp
Cho hỗn hợp gồm Al, Mg, Al(OH)3, Al2O3, MgO vào dung dịch NaOH dư còn lại rắn X. X gồm
A. Mg, MgO
B. Al2O3, Al, Al(OH)3
C. Al, Mg
D. Al(OH)3, Al2O3, MgO
Cho 7,6 gam hỗn hợp X gồm Mg và Ca phản ứng vừa đủ với 4,48 lít (đktc) hỗn hợp khí Y gồm Cl2 và O2 thu được 19,85 gam chất rắn Zchỉ gồm các muối clorua và các oxit kim loại. Khối lượng của Mg trong 7,6gam X là A.2,4 gam. B. 1,8 gam. C.4,6 gam. D. 3,6 gam.
Đọc tiếp
Cho 7,6 gam hỗn hợp X gồm Mg và Ca phản ứng vừa đủ với 4,48 lít (đktc) hỗn hợp khí Y gồm Cl2 và O2 thu được 19,85 gam chất rắn Zchỉ gồm các muối clorua và các oxit kim loại. Khối lượng của Mg trong 7,6gam X là
A.2,4 gam.
B. 1,8 gam.
C.4,6 gam.
D. 3,6 gam.
Đáp án D:
Gọi x, y lần lượt là số mol của Cl2 và O2 có trong 0,2 mol hỗn hợp khí Y =>x+y = 0,2(1)
Theo định luật bảo toàn khối lượng:
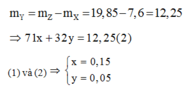
Gọi a, b lần lượt là số mol của Mg và Ca
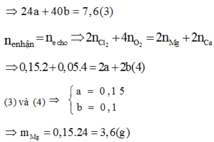
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn hỗn hợp A gồm 2 ankan X , Y ( X Y ) liên tiếp nhau trong dãy đồng đẳng thu được sản phẩm cháy gồm 1,53g nước và 1,344 lít CO2 (đktc)
a/ Xác định công thức phân tử 2 ankan
b/ Tính % theo khối lượng mỗi ankan trong hỗn hợp A
c/ Cho Y tác dụng với clo theo tỉ lệ mol 1:2 thì thu được bao nhiêu dẫn xuất điclo ? Viết các phương trình phản ứng xảy ra ?
Đọc tiếp
Đốt cháy hoàn toàn hỗn hợp A gồm 2 ankan X , Y ( X < Y ) liên tiếp nhau trong dãy đồng đẳng thu được sản phẩm cháy gồm 1,53g nước và 1,344 lít CO2 (đktc)
a/ Xác định công thức phân tử 2 ankan
b/ Tính % theo khối lượng mỗi ankan trong hỗn hợp A
c/ Cho Y tác dụng với clo theo tỉ lệ mol 1:2 thì thu được bao nhiêu dẫn xuất điclo ? Viết các phương trình phản ứng xảy ra ?
Gọi CT chung của 2 anken là CnH2n+2
\(\left\{{}\begin{matrix}n_{H2O}=\frac{1,53}{18}=0,085\left(mol\right)\\n_{CO2}=\frac{1,344}{22,4}=0,06\left(mol\right)\end{matrix}\right.\)
\(C_nH_{2n+2}+\frac{3}{2}O_2\rightarrow nCO_2+\left(n+1\right)H_2O\)
\(n_{H\left(H2O\right)}=n_{H\left(CnH2n+2\right)}=0,085.2=0,17\left(mol\right)\)
\(n_{C\left(CnH2n+2\right)}=n_{C\left(CO2\right)}=0,06\left(mol\right)\)
CT : CnH2n+2 có:
\(\frac{\overline{n}}{2n+2}=\frac{n_C}{n_H}=\frac{0,06}{0,17}\)
\(\Leftrightarrow\overline{n}=2,4\)
Vậy CTPT của 2 anken là C2H6 và C3H8
Đúng 0
Bình luận (0)
cho 3,6g hỗn hợp X gồm Zn,Al,Fe,Mg. Trong đó số mol Mg=Tổng số mol 3 chất còn lại . Hòa tan hết X trong HCl thu được 2,464l H2. Mặt khác khi cho 3,6g X nói trên tác dụng với lượng dư Cl2 đun nóng thì thu được 11,765g hỗn hợp muối gồm AlCl3,FeCl3,ZnCl2 và MgCl2. Tính khối lượng mỗi loại có trong 3,6 gam X
Gọi số mol Zn, Al, Fe, Mg lần lượt là a;b;c;d
Ta có: $d=a+b+c;65a+27b+56c+24d=3,6$
Bảo toàn e ta có: $2a+3b+2c+2d=0,22$
Bảo toàn Zn, Al, Fe, Mg ta có: $136a+133,5b+162,5c+95d=11,765$
Giải hệ 4 ẩn ta được $a=b=0,02;c=0,01;d=0,05$
Đúng 0
Bình luận (0)
Hỗn hợp X gồm Mg và Fe3O4 (trong đó Mg chiem 9.375% khoi luong X). Cho một lượng X tan hết vào dung dịch gồm H2SO4 2M và KNO3 1M, thu được dung dịch Y chỉ chứa 17,87 gam muối trung hòa và 224 ml NO (đktc, sản phẩm khử duy nhất). Cho Y tác dụng với dung dịch Ba(OH)2 dư, thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 30,88. B. 30,37. C. 15,63. D. 17,77.
Theo gt ta có: \(n_{Mg}=n_{Fe_3O_4}=\dfrac{m}{256}\left(mol\text{ }\right)\)
$\Rightarrow m_{KL}=0,75m(g)$
Phương trình khối lượng muối ta có: $0,75m+231x+62x-62.0,01=17,87$
Bảo toàn khối lượng ta có: $m+297x=0,3+17,87+18.2x$
Giải hệ phương trình ta được $m=5,12$
Bảo toàn điện tích ta có $n_{OH^-}=0,19(mol)$
$\Rightarrow m_{kettua}=30,37(g)$
Đúng 2
Bình luận (0)
















