Những câu hỏi liên quan
Fe + O2 > Fe3O4, cho t hỏi là tại sao sản phẩm không phải là Fe2O3 vậy, pt thì mình có thể tự cân bằng được
vì trong lúc cháy , các phaan tử Fe tiếp xúc với oxi ko đồng đều nên sẽ tạo ra sắt 2 và sắt 3 là t phần chính của oxi sắt từ
Đúng 2
Bình luận (3)
Cho em hỏi là khi khử Fe2O3 bằng H2 thì phản ứng sẽ cho ra sắt và nước luôn hay đấy là quá trình khử Fe2O3 ( + H2) -> Fe3O4 ( + H2 ) -> FeO ( H2 ) -> Fe ạ ?
\(Fe_2O_3\underrightarrow{+H_2}Fe_3O_4\underrightarrow{+H_2}FeO\underrightarrow{+H_2}Fe\)
2 cái đầu ?
Đúng 1
Bình luận (0)
2. Để đốt cháy hết 13,2 gam hỗn hợp gồm bột Fe và Mg cần dùng hết 4,48 lít khí
O2 (đktc) tạo ra sản phẩm là Fe3O4 và MgO theo phản ứng:
Fe + O2 ⎯⎯to→ Fe3O4; Mg + O2 ⎯⎯to→ MgO Tính khối lượng mỗi chất có
trong hỗn hợp ban đầu?
Gọi x, y lần lượt là số mol của Fe và Mg.
Theo đề, ta có: \(56x+24y=13,2\) (*)
Ta có: \(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH:
\(3Fe+2O_2\overset{t^o}{--->}Fe_3O_4\left(1\right)\)
\(2Mg+O_2\overset{t^o}{--->}2MgO\left(2\right)\)
Theo PT(1): \(n_{O_2}=\dfrac{2}{3}.n_{Fe}=\dfrac{2}{3}x\left(mol\right)\)
Theo PT(2): \(n_{O_2}=\dfrac{1}{2}.n_{Mg}=\dfrac{1}{2}y\left(mol\right)\)
\(\Rightarrow\dfrac{2}{3}x+\dfrac{1}{2}y=0,2\) (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}56x+24y=13,2\\\dfrac{2}{3}x+\dfrac{1}{2}y=0,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,15\\y=0,2\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)
\(m_{Mg}=0,2.24=4,8\left(g\right)\)
Đúng 1
Bình luận (0)
Có 6,96 hh X gồm FeO, Fe2O3, Fe3O4. Khử hoàn toàn hh trên bằng khí H2 thu đc m gam nước và 5,04g Fe. Tính giá trị của m và số mol HCl cần dùng để phản ứng vừa đủ với 6,96g hh X. Biết X tác dụng với dd HCl tạo ra hh sản phẩm gồm FeCl2, FeCl3 và H2O
Cho m gam hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 tan hết vào dung dịch HNO3 loãng (dư), sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch X và 4,48 lít khí NO (sản phẩm khử duy nhất, ở đktc). Biết số mol Fe(NO3)3 đã tạo thành là 0,40 mol. Giá trị của m là A. 96,8 B. 27,2 C. 89,2 D. 36,4
Đọc tiếp
Cho m gam hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 tan hết vào dung dịch HNO3 loãng (dư), sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch X và 4,48 lít khí NO (sản phẩm khử duy nhất, ở đktc). Biết số mol Fe(NO3)3 đã tạo thành là 0,40 mol. Giá trị của m là
A. 96,8
B. 27,2
C. 89,2
D. 36,4
Đáp án B
Quy đổi hỗn hợp về Fe và O. Đặt nFe = a và nO = b
+ Vì HNO3 dư và nFe(NO3)3 = 0,4 mol ⇒ nFe = a = 0,4 mol
+ Áp dụng bảo toàn e ta có: 3nFe = 2nO + 3nNO
⇒ nO = 0,3 mol ⇒ m = 0,4×56 + 0,3×16 = 27,2 gam
Đúng 0
Bình luận (0)
Câu 8: Lập phương trình hóa học ứng với các sơ đồ phản ứng sau đây?(a) Al + Fe3O4 -----Al2O3 + Fe(b) Fe2O3 + CO----- Fe + CO2(c) Fe3O4 + CO Fe -----+ CO2(d) Fe3O4 + HCl -----FeCl2 + FeCl3 + H2O(e) Fe(OH)2 + O2 + H2O Fe(O-----H)3(f) Fe(OH)2 + O2 -----Fe2O3 + H2O(g) C2H6O + O2 -----CO2 + H2O(h) C4H8O2 + O2 ----------CO2 + H2O(i) C3H9N + O2 -----CO2 + N2+ H2O(k) C2H5O2N + O2 -----CO2 + N2 + H2O(l) Na2CO3 + CaCl2 -----CaCO3 + NaCl(m) Ba(OH)2 + H3PO4 -----Ba3(PO4)2 + H2O(n) Na2SO4 + Ba(NO3)2 -----Ba...
Đọc tiếp
Câu 8: Lập phương trình hóa học ứng với các sơ đồ phản ứng sau đây?
(a) Al + Fe3O4 ----->Al2O3 + Fe
(b) Fe2O3 + CO-----> Fe + CO2
(c) Fe3O4 + CO Fe ----->+ CO2
(d) Fe3O4 + HCl ----->FeCl2 + FeCl3 + H2O
(e) Fe(OH)2 + O2 + H2O Fe(O----->H)3
(f) Fe(OH)2 + O2 ----->Fe2O3 + H2O
(g) C2H6O + O2 ----->CO2 + H2O
(h) C4H8O2 + O2 ----------CO2 + H2O
(i) C3H9N + O2 ----->CO2 + N2+ H2O
(k) C2H5O2N + O2 ----->CO2 + N2 + H2O
(l) Na2CO3 + CaCl2 ----->CaCO3 + NaCl
(m) Ba(OH)2 + H3PO4 ----->Ba3(PO4)2 + H2O
(n) Na2SO4 + Ba(NO3)2 ----->BaSO4 + NaNO3
(o) (NH4)2SO4 + Ba(OH)2 ----->BaSO4 + NH3 + H2O
(p) MnO2 + HCl ----->MnCl2 + Cl2 + H2O
3. Cho 8,16 gam hỗn hợp X gồm Fe, FeO, Fe3O4, và Fe2O3 phản ứng hết với dung dịch HNO3 loãng dư, thu được 1,344 lít NO (đktc, sản phẩm chủ duy nhất) và dung dịch Y. Tính khối lượng muối khan thu được khi cô cạn dung dịch Y (không cần ghi các phương trình phản ứng).
Quy đổi thành: Fe (a mol), O (b mol)
\(56a+16b=8,16\\ 3a=3\cdot\dfrac{1,344}{22,4}+2b\\ \Rightarrow a=0,12;b=0,09\\ m_{Fe\left(NO_3\right)_3}=0,12\cdot242=29,04g\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn m gam hỗn hợp X gồm FeO,
F
e
2
O
3
,
F
e
3
O
4
,
F
e
S
2
cần dùng 0,6 mol
O
2
, thu được 0,4 mol
F
e
2
O...
Đọc tiếp
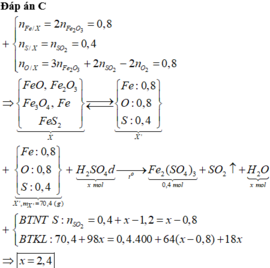
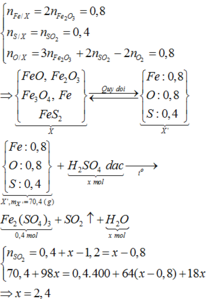
Đốt cháy hoàn toàn m gam hỗn hợp X gồm FeO, F e 2 O 3 , F e 3 O 4 , F e S 2 cần dùng 0,6 mol O 2 , thu được 0,4 mol F e 2 O 3 và 0,4 mol S O 2 . Cho m gam hỗn hợp X trên tác dụng với dung dịch H 2 S O 4 đặc nóng, dư đến khi các phản ứng xảy ra hoàn toàn, sản phẩm khử duy nhất là S O 2 thì số mol H 2 S O 4 tham gia phản ứng là bao nhiêu
A. 2,8 mol.
B. 2,0 mol.
C. 2,4 mol.
D. 1,6 mol.
Đốt cháy hoàn toàn m gam hỗn hợp X gồm FeO, Fe2O3, Fe3O4, FeS2 cần dùng 0,6 mol O2, thu được 0,4 mol Fe2O3 và 0,4 mol SO2. Cho m gam hỗn hợp X trên tác dụng với dung dịch H2SO4 đặc nóng, dư đến khi các phản ứng xảy ra hoàn toàn, sản phẩm khử duy nhất là SO2 thì số mol H2SO4 tham gia phản ứng là bao nhiêu? A. 2,8 mol B. 2,0 mol C. 2,4 mol D. 1,6 mol
Đọc tiếp
Đốt cháy hoàn toàn m gam hỗn hợp X gồm FeO, Fe2O3, Fe3O4, FeS2 cần dùng 0,6 mol O2, thu được 0,4 mol Fe2O3 và 0,4 mol SO2. Cho m gam hỗn hợp X trên tác dụng với dung dịch H2SO4 đặc nóng, dư đến khi các phản ứng xảy ra hoàn toàn, sản phẩm khử duy nhất là SO2 thì số mol H2SO4 tham gia phản ứng là bao nhiêu?
A. 2,8 mol
B. 2,0 mol
C. 2,4 mol
D. 1,6 mol