
Những câu hỏi liên quan
Mọi người giúp mình giải BT này với ạ! Mình xin cảm ơn!
BT: . Oxi hoá hoàn toàn 0,135 g HCHC A rồi cho sản phẩm lần lượt qua bình 1 chứa H2SO4 đặc và bình 2 chứa KOH, thì thấy khối lượng bình 1 tăng lên 0,117 g, bình 2 tăng thêm 0,396 g. Ở thí nghiệm khác, khi nung 1,35 g hợp chất A với CuO thì thu được 112 ml (đktc) khí nitơ. Lập CTĐGN
Xem chi tiết
Ta có: \(m_{b1tang}=m_{H_2O}\Rightarrow n_{H_2O}=\dfrac{0,117}{18}=0,0065\left(mol\right)\)
\(\Rightarrow n_H=2n_{H_2O}=0,013\left(mol\right)\)
\(m_{b2tang}=m_{CO_2}\Rightarrow n_{CO_2}=\dfrac{0,396}{44}=0,009\left(mol\right)\)
\(\Rightarrow n_C=2n_{CO_2}=0,009\left(mol\right)\)
Khi nung 1,35 g A thì thu được: \(n_{N_2}=\dfrac{0,112}{22,4}=0,005\left(mol\right)\)
\(\Rightarrow\) Khi oxi hóa 0,135 g A thì thu được 0,0005 mol N2.
\(\Rightarrow n_N=2n_{N_2}=0,001\left(mol\right)\)
Vì đốt cháy A thu được CO2, H2O và N2 nên A chắc chắn có C, H, N và có thể có O.
Có: mC + mH + mN = 0,009.12 + 0,013.1 + 0,001.14 = 0,135 (g) = mA.
Vậy: A gồm C, H, N.
Giả sử CTPT của A là: CxHyNt (x, y, t nguyên dương).
⇒ x : y : t = 9 : 13 : 1
Vậy: CTĐGN của A là C9H13N.
Bạn tham khảo nhé!
Đúng 1
Bình luận (0)
Oxi hoá hoàn toàn 0,135 g hợp chất hữu cơ A rồi cho sản phẩm lần lượt qua bình 1 chứa H2SO4 đặc và bình 2 chứa KOH, thì thấy khối lượng bình 1 tăng lên 0,117 g, bình 2 tăng thêm 0,396 g. Ở thí nghiệm khác, khi nung 1,35 g hợp chất A với CuO thì thu được 112 ml (đktc) khí nitơ. Tính thành phần phần trăm của các nguyên tố trong phân tử chất A
TN1: \(n_{H_2O}=\dfrac{0,117}{18}=0,0065\left(mol\right)\)
\(n_{CO_2}=\dfrac{0,396}{44}=0,009\left(mol\right)\)
Bảo toàn C: nC = 0,009 (mol)
Bảo toàn H: nH = 0,013 (mol)
TN2:\(n_{N_2}=\dfrac{0,112}{22,4}=0,005\left(mol\right)\)
Bảo toàn N: nN = 0,01 (mol)
=> Trong 1,35g A chứa 0,01 mol N
=> Trong 0,135g A chứa 0,001 mol N
=> \(n_O=\dfrac{0,135-12.0,009-1.0,013-0,001.14}{16}=0\left(mol\right)\)
Có: nC : nH : nO = 0,009 : 0,013 : 0,001 = 9:13:1
=> CTHH: (C9H13N)n
=> \(\left\{{}\begin{matrix}\%m_C=\dfrac{12.9n}{135n}.100\%=80\%\\\%m_H=\dfrac{13n}{135n}.100\%=9,63\%\\\%m_N=\dfrac{14n}{135n}.100\%=10,37\%\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Đốt cháy hoàn toàn 1 hidrocacbon A ( là chất khí, đkc) rồi dẫn sản phẩm lần lượt qua bình 1 đựng H2SO4 đặc và bình 2 chứa NaOH dư người ta thấy khối lượng bình I tăng 1,8g và khối lượng bình 2 tăng 3,52 gam. XĐ CTPT của A. A. C4H10 B. C3H8 C. C5H12 D. C6H14
Đọc tiếp
Đốt cháy hoàn toàn 1 hidrocacbon A ( là chất khí, đkc) rồi dẫn sản phẩm lần lượt qua bình 1 đựng H2SO4 đặc và bình 2 chứa NaOH dư người ta thấy khối lượng bình I tăng 1,8g và khối lượng bình 2 tăng 3,52 gam. XĐ CTPT của A.
A. C4H10
B. C3H8
C. C5H12
D. C6H14
Đáp án A
Khối lượng bình 1 tăng là khối lượng của H2O => nH2O = 1,8/18 = 0,1 mol
Khối lượng bình 2 tăng là khối lượng của CO2 => nCO2 = 3,52/44 = 0,08 mol
Nhận thấy: nCO2 < nH2O => hidrocacbon là ankan;
Số mol ankan là nankan = 0,1 – 0,08 = 0,02 mol
Phương trình phản ứng:
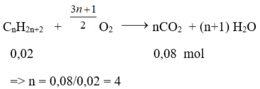
CTPT của A là C4H10
Đúng 0
Bình luận (0)
Oxi hoá hoàn toàn 0,60(g) một ancol A đơn chức bằng oxi không khí, sau đó dẫn sản phẩm qua bình 91 đựng H2SO4 đặc rồi dẫn tiếp qua bình (2) đựng KOH. Khối lượng bình (1) tăng 0,72g; bình (2) tăng 1,32g. Giải thích hiện tượng thí nghiệm trên bằng phương trình hoá học.
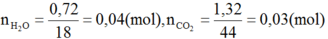
⇒ nH2O > nCO2
⇒ A là ancol no và theo đầu bài là đơn chức
Gọi công thức phân tử của A là CnH2n+2O (n ≥ 1)
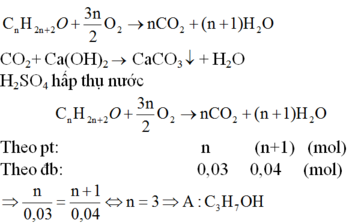
Đúng 0
Bình luận (0)
1/ Dẫn 6,72 lít hỗn hợp khí A gồm propan, axetilen, propilen lần lượt qua bình 1 chứa dung dịch AgNO3 dư trong NH3, rồi qua bình 2 chứa dung dịch Br2 dư. Ở bình 1 có 36 g kết tủa, bình 2 tăng lên 4,2 g.a/ Tính % theo thể tích mỗi chất trong hỗn hợp A.b/ Đốt cháy 6,72 lít hỗn hợp khí A, sau đó dẫn sản phẩm cháy qua dung dịch nước vôi trong dư thấy khối lượng bình tăng lên m gam và có a gam kết tủa. Tính giá trị m và a.2/ Cho 35g hỗn hợp gồm 2 ancol no, đơn, mạch hở kế tiếp nhau trong dãy đồng đẳn...
Đọc tiếp
1/ Dẫn 6,72 lít hỗn hợp khí A gồm propan, axetilen, propilen lần lượt qua bình 1 chứa dung dịch AgNO3 dư trong NH3, rồi qua bình 2 chứa dung dịch Br2 dư. Ở bình 1 có 36 g kết tủa, bình 2 tăng lên 4,2 g.
a/ Tính % theo thể tích mỗi chất trong hỗn hợp A.
b/ Đốt cháy 6,72 lít hỗn hợp khí A, sau đó dẫn sản phẩm cháy qua dung dịch nước vôi trong dư thấy khối lượng bình tăng lên m gam và có a gam kết tủa. Tính giá trị m và a.
2/ Cho 35g hỗn hợp gồm 2 ancol no, đơn, mạch hở kế tiếp nhau trong dãy đồng đẳng tác dụng với Na dư thu được 7,84 lít H2.
a/ Tìm CTPT của 2 ancol trên.
b/ Đốt cháy hoàn toàn hỗn hợp 2 ancol trên sau đó sản phẩm qua bình 1 chứa H2SO4 và bình 2 chứa Ca(OH)2 nhận thấy bình 1 tăng m1 gam và bình 2 tăng lên m2 gam. Tính giá trị m1 và m2.
Giúp mình nhé mai mình thi học kì. Cảm ơn mọi người.
a/ Tính % theo thể tích mỗi chất trong hỗn hợp A.
b/ Đốt cháy 6,72 lít hỗn hợp khí A, sau đó dẫn sản phẩm cháy qua dung dịch nước vôi trong dư thấy khối lượng bình tăng lên m gam và có a gam kết tủa. Tính giá trị m và a.
2/ Cho 35g hỗn hợp gồm 2 ancol no, đơn, mạch hở kế tiếp nhau trong dãy đồng đẳng tác dụng với Na dư thu được 7,84 lít H2.
a/ Tìm CTPT của 2 ancol trên.
b/ Đốt cháy hoàn toàn hỗn hợp 2 ancol trên sau đó sản phẩm qua bình 1 chứa H2SO4 và bình 2 chứa Ca(OH)2 nhận thấy bình 1 tăng m1 gam và bình 2 tăng lên m2 gam. Tính giá trị m1 và m2.
Giúp mình nhé mai mình thi học kì. Cảm ơn mọi người.
Hợp chất hữu cơ X chứa C, H, O. Đốt cháy hoàn toàn 7,4 gam X rồi dẫn sản phẩm cháy qua bình 1 đựng H2SO4 đặc và bình 2 đựng dung dịch KOH dư thấy khối lượng bình 1 và bình 2 tăng lần lượt 5,4 gam và 13,2 gam. Hãy xác định hàm lượng % các nguyên tố C, H, O trong X.
Oxi hóa hoàn toàn 4,92g một hợp chất A chứa C, H, O, N rồi cho sản phẩm lần lượt qua bình chứa
H
2
SO
4
đậm đặc, bình chứa KOH thì thấy khối lượng bình chứa
H
2
SO
4
đặc tăng thêm 1,81g, bình chứa KOH tăng thêm 10,56g. Ở thí nghiệm khác, khi nung 6,15g hợp chất A với CuO thì thu được 0,55l (đktc) khí
N
2...
Đọc tiếp
Oxi hóa hoàn toàn 4,92g một hợp chất A chứa C, H, O, N rồi cho sản phẩm lần lượt qua bình chứa H 2 SO 4 đậm đặc, bình chứa KOH thì thấy khối lượng bình chứa H 2 SO 4 đặc tăng thêm 1,81g, bình chứa KOH tăng thêm 10,56g. Ở thí nghiệm khác, khi nung 6,15g hợp chất A với CuO thì thu được 0,55l (đktc) khí N 2 . Hàm lượng phần trăm của Oxi trong A là bao nhiêu?
A. 26,215%
B. 58,54%
C.11,18%
C. 4,065%
Hãy xác định CTPT của luminol. Biết khi oxi hoá hoàn toàn 2,895 gam luminol bằng oxi rồi dẫn sản phẩm lần lượt qua bình một chứa CaCl2 khan, bình hai chứa dung dịch Ca(OH)2 thì thấy khối lượng bình 1 tăng 0,945 gam và khối lượng bình 2 tăng 5,28 gam. Mặt khác, khi phân tích 6,369 gam luminol thì thu được 1,1088 lít khí N2 (đktc). Cho tỉ khối hơi của luminol so với không khí là 6,65518
Đọc tiếp
Hãy xác định CTPT của luminol. Biết khi oxi hoá hoàn toàn 2,895 gam luminol bằng oxi rồi dẫn sản phẩm lần lượt qua bình một chứa CaCl2 khan, bình hai chứa dung dịch Ca(OH)2 thì thấy khối lượng bình 1 tăng 0,945 gam và khối lượng bình 2 tăng 5,28 gam. Mặt khác, khi phân tích 6,369 gam luminol thì thu được 1,1088 lít khí N2 (đktc). Cho tỉ khối hơi của luminol so với không khí là 6,65518
\(M_{luminol}=6,65518.29=193\left(g/mol\right)\)
\(n_{N_2}=\dfrac{1,1088}{22,4}=0,0495\left(mol\right)\)
Phân tích 6,369 gam luminol thu được 0,0495 mol khí N2
`=>` Phân tích 2,895 gam luminol thu được 0,0225 mol khí N2
Ta có: \(\left\{{}\begin{matrix}m_{b\text{ìn}h.1.t\text{ăng}}=m_{H_2O}=0,945\left(g\right)\\m_{b\text{ình}.2.t\text{ăng}}=m_{CO_2}=5,28\left(g\right)\end{matrix}\right.\)
`=>` \(\left\{{}\begin{matrix}n_{H_2O}=\dfrac{0,945}{18}=0,0525\left(mol\right)\\n_{CO_2}=\dfrac{5,28}{44}=0,12\left(mol\right)\end{matrix}\right.\)
`=>` \(\left\{{}\begin{matrix}n_C=n_{CO_2}=0,12\left(mol\right)\\n_H=2n_{H_2O}=0,105\left(mol\right)\\n_N=2n_{N_2}=0,045\left(mol\right)\\n_O=\dfrac{m_{luminol}-m_C-m_H-m_N}{16}=\dfrac{2,895-0,12.12-0,105-0,045.14}{16}=0,045\left(mol\right)\end{matrix}\right.\)
`=>` \(n_C:n_H:n_O:n_N=0,12:0,105:0,045:0,045=8:7:3:3\)
`=>` CTHH của luminol có dạng \(\left(C_8H_7O_3N_3\right)_n\)
`=>` \(n=\dfrac{193}{193}=1\)
Vậy CTHH của luminol là C8H7O3N3
Đúng 2
Bình luận (0)
Oxi hoá hoàn toàn 0,60(g) một ancol A đơn chức bằng oxi không khí, sau đó dẫn sản phẩm qua bình 91 đựng H2SO4 đặc rồi dẫn tiếp qua bình (2) đựng KOH. Khối lượng bình (1) tăng 0,72g; bình (2) tăng 1,32g. Tìm công thức phân tử, viết công thức cấu tạo có thể có của A.
CTCT có thể có của A là:
CH3-CH2-CH2-OH, CH3-CH(OH)-CH3
Đúng 0
Bình luận (0)

















