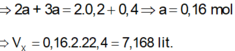Một lít hỗn hợp gồm C3H8 và CH4 có thể tích bằng nhau đo ở điều kiện tiêu chuẩn có khối lượng là :
A. 0,7891 g
B. 1,3392 g
C. 1,4853 g
D. 1.9874 g
Giải thích giùm mik luôn vs !

Những câu hỏi liên quan
trộn V1 lít CH4 với V2 lít C2H4 thu được hỗn hợp khí X có khối lượng riêng bằng khối lượng riêng của C2H2 (các thể tích khí đo ở điều kiện tiêu chuẩn).Tỉ lệ thể tích V1:V2 bằng
a. 1:3
b. 1:4
c. 1:5
d. 1:6
Ta có
`\overline(M)=(16V_1+28V_2)/(V_1+V_2)=26`
`=>10V_1=2V_2`
`=>V_1:V_2=2:10=1:5`
`->C`
Đúng 2
Bình luận (0)
Một lít hỗn hợp gồm hai chất khí C3H8 và CH4 có thể tích bằng nhau. Xác định khối lượng của hỗn hợp??
Ở điều kiện tiêu chuẩn 3,36 lít hỗn hợp khí gồm CH4 và C2H4 có khối lượng 3 gam A Tính phần trăm theo thể tích và theo khối lượng mỗi khí trong hỗn hợp B Dẫn 3,36 lít hỗn hợp khí trên qua bình chứa dung dịch brom dư thấy dung dịch Brom bị nhạt màu và khối lượng tăng thêm M gam. Tính m
a, Ta có: \(n_{CH_4}+n_{C_2H_4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\left(1\right)\)
\(16n_{CH_4}+28n_{C_2H_4}=3\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CH_4}=0,1\left(mol\right)\\n_{C_2H_4}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{0,1.16}{3}.100\%\approx53,33\%\\\%m_{C_2H_4}\approx46,67\%\end{matrix}\right.\)
- Ở cùng điều kiện nhiệt độ và áp suất, % số mol cũng là %V.
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,1}{0,15}.100\%\approx66,67\%\\\%V_{C_2H_4}\approx33,33\%\end{matrix}\right.\)
b, PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Có: m tăng = mC2H4 = 0,05.28 = 1,4 (g)
Đúng 1
Bình luận (0)
a) \(n_{hh}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=a\left(mol\right)\\n_{C_2H_4}=b\left(mol\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a+b=0,15\\16a+28b=3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,05\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,1}{0,15}.100\%=66,67\%\\\%V_{C_2H_4}=100\%-66,67\%=33,33\%\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{0,1.16}{3}.100\%=53,33\%\\\%m_{C_2H_4}=100\%-53,33\%=46,67\%\end{matrix}\right.\)
b) \(m=m_{C_2H_4}=0,05.28=1,4\left(g\right)\)
Đúng 2
Bình luận (0)
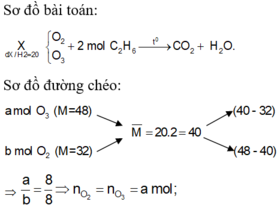
Hỗn hợp X gồm O2 và O3 có tỉ khối so với H2 bằng 20. Để đốt cháy hoàn toàn 4,48 lít khí CH4 cần V lít hỗn hợp khí X. Các khí đo ở điều kiện tiêu chuẩn. Gía trị của V là: A. 3,584 lit B. 4,480 lit C. 8,960 lit D. 7,168 lit
Đọc tiếp
Hỗn hợp X gồm O2 và O3 có tỉ khối so với H2 bằng 20. Để đốt cháy hoàn toàn 4,48 lít khí CH4 cần V lít hỗn hợp khí X. Các khí đo ở điều kiện tiêu chuẩn. Gía trị của V là:
A. 3,584 lit
B. 4,480 lit
C. 8,960 lit
D. 7,168 lit
Đốt cháy hoàn toàn v lít hỗn hợp khí CH4 và H2 có tỉ khối đối với Hidro là 4,5 cần dùng 56 l khí không khí biết thể tích không khí gấp 5 lần thể tích Oxi và có thể tích đo được ở điều kiện tiêu chuẩn
\(M_{hỗn\ hợp} = 4,5.2 = 9\\ Gọi : n_{CH_4} = a(mol) ; n_{H_2} = b(mol)\\ \Rightarrow 16a + 2b =9(a + b)\ (1) n_{O_2} = \dfrac{56}{5.22,4} = 0,5(mol)\\ CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ 2H_2 + O_2 \xrightarrow{t^o} 2H_2O\\ n_{O_2} = 2a + 0,5b = 0,5(2)\\ (1)(2) \Rightarrow a = 0,2 ; b = 0,2\\ \Rightarrow V = (0,2 + 0,2).22,4 = 8,96(lít)\)
Đúng 1
Bình luận (0)
Đề không hợp lí em ơi, CO2 và H2O đều không cháy được nhé.
Đúng 1
Bình luận (1)
Đốt cháy hoàn toàn 13,44 lít hỗn hợp khí CH4 và C2H4, biết tỉ lệ thể tích giữa CH4 và C2H4 là 1:2. a, viết PTHH của phản ứng b, Tính thể tích khí CO2 sinh ra( biết thể tích các khí đc đo ở điều kiện tiêu chuẩn) giúp mình luôn với ạ
a) CH4 + 2O2 \(\underrightarrow{t^o}\) CO2 + 2H2O.
C2H4 + 3O2 \(\underrightarrow{t^o}\) 2CO2 + 2H2O.
b) Gọi x là lượng CH4 ban đầu, lượng C2H4 ban đầu là 2x.
Ta có: x+2x=13,44/22,4 \(\Rightarrow\) x=0,2.
Thể tích khí CO2 sinh ra là \(V_{CO_2}\)=(0,2+0,2.2.2).22,4=22,4 (lít).
Đúng 3
Bình luận (0)
Một hỗn hợp X có thể tích 17,92 lít gồm hiđro và axetilen (C2H2), có tỉ khối so với nitơ là 0,5. Đốt hỗn hợp X với 35,84 lít khí oxi. Phản ứng xong, làm lạnh để hơi nước ngưng tụ hết thu được hỗn hợp khí Y. Các khí đều đo ở điều kiện tiêu chuẩn. Xác định thành phần % theo thể tích và theo khối lượng của các chất trong Y. Biết axetilen cháy theo sơ đồ phản ứng sau: C2H2 + O2 -- CO2 + H2O
Đọc tiếp
Một hỗn hợp X có thể tích 17,92 lít gồm hiđro và axetilen (C2H2), có tỉ khối so với nitơ là 0,5. Đốt hỗn hợp X với 35,84 lít khí oxi. Phản ứng xong, làm lạnh để hơi nước ngưng tụ hết thu được hỗn hợp khí Y. Các khí đều đo ở điều kiện tiêu chuẩn. Xác định thành phần % theo thể tích và theo khối lượng của các chất trong Y. Biết axetilen cháy theo sơ đồ phản ứng sau: C2H2 + O2 --> CO2 + H2O
Gọi số mol H2, C2H2 là a, b (mol)
=> \(\left\{{}\begin{matrix}a+b=\dfrac{17,92}{22,4}=0,8\left(mol\right)\\\overline{M}=\dfrac{2a+26b}{a+b}=0,5.28=14\left(g/mol\right)\end{matrix}\right.\)
=> a = 0,4 (mol); b = 0,4 (mol)
\(n_{O_2}=\dfrac{35,84}{22,4}=1,6\left(mol\right)\)
PTHH: 2C2H2 + 5O2 --to--> 4CO2 + 2H2O
0,4--->1----------->0,8
2H2 + O2 --to--> 2H2O
0,4-->0,2
=> Y gồm \(\left\{{}\begin{matrix}CO_2:0,8\left(mol\right)\\O_{2\left(dư\right)}:0,4\left(mol\right)\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%V_{CO_2}=\dfrac{0,8}{0,8+0,4}.100\%=66,67\%\\\%V_{O_2}=\dfrac{0,4}{0,8+0,4}.100\%=33,33\%\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{CO_2}=\dfrac{0,8.44}{0,8.44+0,4.32}.100\%=73,33\%\\\%m_{O_2\left(dư\right)}=\dfrac{0,4.32}{0,8.44+0,4.32}.100\%=26,67\%\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Một hỗn hợp X có thể tích 17,92 lít gồm hiđro và axetilen C2H2 , có tỉ khối so với nitơ là 0,5. Đốt hỗn hợp X với 35,84 lít khí oxi. Phản ứng xong, làm lạnh để hơi nước ngưng tụ hết được hỗn hợp khí Y. Các khí đều đo ở điều kiện tiêu chuẩn.
1) Viết phương trình hoá học xảy ra.
2) Xác định % thể tích và % khối lượng của Y.
1)
2H2 + O2 --to--> 2H2O
2C2H2 + 5O2 --to--> 4CO2 + 2H2O
2) Gọi số mol H2, C2H2 là a, b
=> \(\left\{{}\begin{matrix}a+b=\dfrac{17,92}{22,4}=0,8\\\dfrac{2a+26b}{a+b}=0,5.28=14\end{matrix}\right.=>\left\{{}\begin{matrix}a=0,4\\b=0,4\end{matrix}\right.\)
\(n_{O_2}=\dfrac{35,84}{22,4}=1,6\left(mol\right)\)
PTHH: 2H2 + O2 --to--> 2H2O
0,4--->0,2
2C2H2 + 5O2 --to--> 4CO2 + 2H2O
0,4---->1-------------->0,8
=> \(\left\{{}\begin{matrix}n_{O_2}=1,6-0,2-1=0,4\left(mol\right)\\n_{CO_2}=0,8\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%V_{O_2}=\dfrac{0,4}{0,4+0,8}.100\%=33,33\%\\\%V_{CO_2}=\dfrac{0,8}{0,4+0,8}.100\%=66,67\%\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%m_{O_2}=\dfrac{0,4.32}{0,4.32+0,8.44}.100\%=26,67\%\\\%m_{CO_2}=\dfrac{0,8.44}{0,4.32+0,8.44}.100\%=73,33\%\end{matrix}\right.\)
Đúng 2
Bình luận (0)
đốt cháy 6,8 gam hỗn hợp X gồm hidro và cacbon monooxit cần 8,96 lít oxi (đo ở điều kiện tiêu chuẩn) . xác định thành phần phần trăm theo thể tích và khối lượng hỗn hợp X .
Pthh : 2CO + O2 2CO2 (1)
x mol mol x mol
2H2 + O2 2H2O (2)
y mol mol y mol
Số mol oxi: = 0,400 (mol)
Theo đầu bài ta có:
Tính ra: x = 0,200; y= 0,600
Phần trăm thể tích bằng phần trăm số mol: 75,0% H2 và 25,0%CO
Phần trăm khối lượng khí hidro: x 100% = 17,6%
Phần trăm khối lượng khí CO là 82,4%.
Đúng 0
Bình luận (0)