Tính khối lượng nguyên tố P trong Ca(H2PO4)2
tính phần trăm về khối lượng các nguyên tố trong các hợp chất sau: CA(H2PO4)2 và (NH4)2HPO
please help me
* Giả sử n Ca(H2PO4)2=1 (mol) =n Ca trong Ca(H2PO4)2 = 4n H trong Ca(H2PO4)2 = 2n P trong Ca(H2PO4)2 = 8n O trong Ca(H2PO4)2
=> m Ca(H2PO4)2= 234 (g)
%m Ca trong Ca(H2PO4)2 = 40/234*100=17.09%
%m H trong Ca(H2PO4)2= 4/234*100=1.71%
%m P trong Ca(H2PO4)2= (2*31)/234*100=26,5%
%m O trong Ca(H2PO4)2= (8*16)/234*100=54.7%
*Cái (NH4)2HPO4 tương tụ nhé. Mà (NH4)2HPO là (NH4)2HPO4 chứ nhỉ?
Một mẫu supephotphat đơn khối lượng 15,55 g chứa 35,43% C a ( H 2 P O 4 ) 2 , còn lại là C a S O 4 . Tính tỉ lệ % P 2 O 5 trong mẫu supephotphat đơn trên.
Khối lượng C a ( H 2 P O 4 ) 2 trong 15,55 g supephotphat đơn:
![]()
Khối lượng P 2 O 5 trong mẫu supephotphat đơn trên :
1 C a ( H 2 P O 4 ) 2 - 1 P 2 O 5
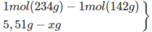
![]()
% về khối lượng của
P
2
O
5
: ![]()
Tính thành phần % khối lượng các nguyên tố có trong hợp chất sau:
a) Al2O3 b) Ca(HPO4)2
a, \(\%m_{Al}=\dfrac{54.100\%}{102}=53\%\)
\(\%m_O=100\%-53\%=47\%\)
b, \(\%m_{Ca}=\dfrac{40.100\%}{232}=17,24\%\)
\(\%m_H=\dfrac{2.100\%}{232}=0,86\%\)
\(\%m_P=\dfrac{62.100\%}{232}=26,72\%\)
\(\Rightarrow\%m_O=100\%-17,24\%-0,86\%-26,72\%=55,18\%\)
a/ Tính khối lượng các nguyên tố có trong 0,3 mol Ca(NO3)2.
b/ Tính khối lượng Fe2(SO4)3 có 9,6 gam oxi.
c/ Tính thể tích H2 (đktc) có số phân tử bằng số nguyên tử oxi có trong 3,2 gam CuSO4.
Câu a.
\(M_{Ca\left(NO_3\right)_2}=164\)g/mol
\(m_{Ca\left(NO_3\right)_2}=0,3\cdot164=49,2g\)
\(\%Ca=\dfrac{40}{164}\cdot100\%=24,39\%\)
\(m_{Ca}=\%Ca\cdot49,2=12g\)
\(\%N=\dfrac{14\cdot2}{164}\cdot100\%=17,07\%\)
\(m_N=\%N\cdot49,2=8,4g\)
\(m_O=49,2-12-8,4=28,8g\)
Các câu sau em làm tương tự nhé!
a/ Tính khối lượng các nguyên tố có trong 0,3 mol Ca(NO3)2.
b/ Tính khối lượng Fe2(SO4)3 có 9,6 gam oxi.
c/ Tính thể tích H2 (đktc) có số phân tử bằng số nguyên tử oxi có trong 3,2 gam CuSO4.
a)\(n_{Ca\left(NO_3\right)_2}=0,3mol\)
\(n_{Ca}=n_{Ca\left(NO_3\right)_2}=0,3mol\)
\(m_{Ca}=0,3\cdot40=12g\)
\(n_N=2n_{Ca\left(NO_3\right)_2}=2\cdot0,3=0,6mol\)
\(m_N=0,6\cdot14=8,4g\)
\(n_O=6n_{Ca\left(NO_3\right)_2}=6\cdot0,3=1,8mol\)
\(m_O=1,8\cdot16=28,8g\)
b)\(n_O=\dfrac{9,6}{16}=0,6mol\)
Mà \(n_O=12n_{Fe_2\left(SO_4\right)_3}\Rightarrow n_{Fe_2\left(SO_4\right)_3}=\dfrac{0,6}{12}=0,05mol\)
\(\Rightarrow m=20g\)
c)\(n_{CuSO_4}=\dfrac{3,2}{160}=0,02mol\)
\(n_O=4n_{CuSO_4}=0,08mol=n_{H_2}\)
\(V_{H_2}=0,08\cdot22,4=1,792l\)
Tính thành phần trăm theo khối lượng của các nguyên tố trong các hợp chất sau: Ca(NO3)2
\(\%m_{Ca}=\dfrac{40}{164}.100=24,39\left(\%\right)\\ \%m_N=\dfrac{28}{164}.100=17,07\left(\%\right)\\ \%m_O=\dfrac{48.2}{164}.100=58,54\left(\%\right)\)
$M_{Ca(NO_3)_2} = 164$
$\%Ca = \dfrac{40}{164}.100\% = 24,39\%$
$\%N = \dfrac{14.2}{164}.100\% = 17,07\%$
$\%O = 100% -24,39\% -17,07\% = 58,54%%
tính thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất Ca(NO3)2
1. Tổng số hạt trong nguyên tuwrcuar 1 nguyên tố hóa học là 40 trong đó hạt mang điện nhiều hơn hạt ko mang điện là 12 . Xác định số nơron trong nguyên tử
2.Tính ptk của Al2O3 , Al2 ( SO4)3, Fe(NO3)3, Na3PO4, Ca ( H2PO4)2, Ba3(PO4), ZnSO4, AgCl, NaBr
\(1,\left\{{}\begin{matrix}p=e\\n+p+e=40\\2p-n=12\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}2p+n=40\\2p-n=12\end{matrix}\right.\Leftrightarrow n=\dfrac{40-12}{2}=14\)
\(2,PTK_{Al_2O_3}=2\cdot27+16\cdot3=102\left(đvC\right)\\ PTK_{Al_2\left(SO_4\right)_3}=2\cdot27+\left(32+16\cdot4\right)\cdot3=342\left(đvC\right)\\ PTK_{Fe\left(NO_3\right)_3}=56+\left(14+16\cdot3\right)\cdot3=242\left(đvV\right)\\ PTK_{Na_3PO_4}=23\cdot3+31+16\cdot4=164\left(đvC\right)\\ PTK_{Ca\left(H_2PO_4\right)_2}=40+\left(2+31+16\cdot4\right)\cdot2=234\left(đvC\right)\\ PTK_{Ba_3PO_4}=137\cdot3+31+16\cdot4=506\left(đvC\right)\\ PTK_{ZnSO_4}=65+32+16\cdot4=161\left(đvC\right)\\ PTK_{AgCl}=108+35,5=143,5\left(đvC\right)\\ PTK_{NaBr}=23+80=103\left(đvC\right)\)
2/ một hỗn hợp gồm Al2(SO4)3 và Ca3(PO4)2 có tổng số ngtử Oxi là 43,2 x 1023 ngtử và số ngtử Photpho bằng 2 lần số ngtử Lưu huỳnh
a) Tính khối lượng mỗi chất có trong hỗn hợp
b) Tính khối lượng mỗi nguyên tố có trong hỗn hợp
3/ Một hỗn hợp có 8,4 x 1023 ptử Ca3(PO4)2 và Al2(SO4)3 trong đó có khối lượng ng.tố Oxi là 230,4 gam. Tính khối lượng mỗi nguyên tố có trong hỗn hợp trên
4) Có 145,2 gam hỗn hợp Ca(NO3)2 và CuSO4 với tổng số ptử là 5,4 x 1023 ptử . Tính khối lượng mỗi chất và khối lượng mỗi nguyên tố có trong hỗn hợp
3/ nhỗn hợp = 8,4.1023 : 6.1023 = 1,4 (mol)
nO = 230,4 : 16 = 14,4 (mol)
Gọi nCa3(PO4)2 = x (mol) \(\rightarrow\)![]() nO = 8x (mol)
nO = 8x (mol)
\(\rightarrow\) ![]() nAl2(SO4)3 = 1,4-x (mol) \(\rightarrow\)
nAl2(SO4)3 = 1,4-x (mol) \(\rightarrow\)![]() nO = 12.(1,4-x) (mol)
nO = 12.(1,4-x) (mol)
\(\rightarrow\) ![]() 8x + 12.(1,4-x) = 14,4 \(\rightarrow\)
8x + 12.(1,4-x) = 14,4 \(\rightarrow\) ![]() x = 0,6 (mol)
x = 0,6 (mol)
![]() nCa3(PO4)2= 0,6 (mol)
nCa3(PO4)2= 0,6 (mol) ![]() \(\rightarrow Ca_3\left(PO_4\right)_2=\) 0,6.310 = 186 (g)
\(\rightarrow Ca_3\left(PO_4\right)_2=\) 0,6.310 = 186 (g)
nAl2(SO4)3= 1,4-x = 0,8 (mol) \(\rightarrow^mAl_2\left(SO_4\right)_3\)![]() = 0,8 . 342 = 273,6 (g)
= 0,8 . 342 = 273,6 (g)