Hòa tan hoàn toàn 9,65 gam hỗn hợp 2 kim loại Fe, Al trong dung dịch hỗn hợp HCl và H2SO4 loãng, dư kết thúc thu được 7,28 lít khí H2 (đktc). Phần trăm khối lượng của nhôm trong hỗn hợp ban đầu là
A. 41,97%.
B. 56,48%.
C. 42,53%.
D. 45,32%.
Hòa tan hoàn toàn 5,5 gam hỗn hợp gồm Al và Fe vào lượng dư dung dịch H 2 SO 4 loãng, thu được 4,48 lít H 2 (đktc). Thành phần phần trăm khối lượng của Fe trong hỗn hợp đầu là
A. 50,91%
B. 76,36%
C. 25,45%
D. 12,73%
Hòa tan hoàn toàn 5,5 gam hỗn hợp gồm Al và Fe vào lượng dư dung dịch H2SO4 loãng, thu được 4,48 lít H2 (đktc). Thành phần phần trăm khối lượng của Fe trong hỗn hợp đầu là:
A. 50,91%
B. 76,36%
C. 25,45%
D. 12,73%
Đáp án A
n H 2 = 0 , 2 ( m o l )
=> mhh= mFe + mAl
Bảo toàn electron:
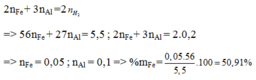
Hòa tan hoàn toàn 13,3 gam hôn hợp 2 kim loại Al và FeHòa tan hoàn toàn 13,3 gam hôn hợp 2 kim loại Al và Fe bằng dung dịch HCl dư thu được 7,84 lít H2 ở đktc.
Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu
Sửa đề : 13.9 (g)
\(n_{Al}=a\left(mol\right),n_{Fe}=b\left(mol\right)\)
\(\Rightarrow m=27a+56b=13.9\left(1\right)\)
\(n_{H_2}=\dfrac{7.84}{22.4}=0.35\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{H_2}=1.5a+b=0.35\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.1,b=0.2\)
\(\%Al=\dfrac{0.1\cdot27}{13.9}\cdot100\%=19.42\%\)
\(\%Fe=100-19.42=80.58\%\)
Hòa tan hoàn toàn 11 gam hỗn hợp 2 kim loại Sắt và Nhôm vào dung dịch H2SO4 loãng vừa đủ, người ta thu được 8,96 lit khí (đktc). Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu
Đặt \(n_{Fe}=x(mol);n_{Al}=y(mol)\Rightarrow 56x+27y=11(1)\)
\(n_{H_2}=\dfrac{8,96}{22,4}=0,4(mol)\\ PTHH:Fe+H_2SO_4\to FeSO_4+H_2\\ 2Al+3H_2SO_4\to Al_2(SO_4)_3+3H_2\\ \Rightarrow x+1,5y=0,4(2)\\ (1)(2)\Rightarrow x=0,1(mol);y=0,2(mol)\\ \Rightarrow \%_{Fe}=\dfrac{0,1.56}{11}.100\%=50,91\%\\ \Rightarrow \%_{Al}=100\%-50,91\%=49,09\%\)
Chia hỗn hợp X gồm K, Al, Fe thành hai phần bằng nhau.
Cho phần 1 vào dung dịch KOH dư thu được 0,784 lít khí H2 (đktc).
Cho phần 2 vào một lượng dư H2O, thu được 0,448 lít khí H2 (đktc) và m gam hỗn hợp kim loại Y. Hòa tan hoàn toàn Y vào dung dịch HCl dư, thu được 0,56 lít khí H2 (đktc). Khối lượng (tính theo gam) của K, Al, Fe trong mỗi phần hỗn hợp X lần lượt là
A. 0,39; 0,54; 0,56
B. 0,39; 0,54; 1,40
C. 0,78; 1,08; 0,56.
D. 0,78; 0,54; 1,12
Chia hỗn hợp X gồm K, AI và Fe thành hai phần bằng nhau.
Cho phần một vào dung dịch KOH (dư) thu được 0,784 lít khí H2 (đktc).
Cho phần hai vào một lượng dư H2O, thu được 0,448 lít khí H2 (đktc) và m gam hỗn hợp kim loại Y. Hòa tan hoàn toàn Y vào dung dịch HCl (dư) thu được 0,56 lít khí H2 (đktc).
Khối lượng (tính theo gam) của K, Al, Fe trong mỗi phần hỗn hợp X lần lượt là
A. 0,39; 0,54; 1,40.
B. 0,78; 0,54;1,12
C. 0,39; 0,54; 0,56
D. 0,78; 1,08;0,56
Hòa tan hoàn toàn 4,5 gam hỗn hợp Mg và Al vào HCl và H2SO4(dư) thu được 7,84 lít khí H2 (đktc)
a. Viết PTHH
b.Tính khối lượng mỗi kim loại có trong hỗn hợp ban đầu
Sửa đề : 7.5 (g)
nMg = a (mol)
nAl = b (mol)
=> 24a + 27b = 7.5 (1)
nH2 = 7.84/22.4 = 0.35 (mol)
Mg + 2H+ => Mg2+ + H2
2Al + 6H+ => 2Al3+ + 3H2
nH2 = a + 1.5b = 0.35 (2)
(1) , (2) :
a= 0.2
b = 0.1
mMg = 4.8 (g)
mAl = 2.7 (g)
Hoà tan hoàn toàn 11 gam hỗn hợp X gồm Al và Fe bằng dung dịch axit sunfuric loãng dư. Sau khi phản ứng phản ứng kết thúc thu được 8,96 lít khí (đktc).
a) Tính thành phần phần trăm về khối lượng mỗi kim loại trong hỗn hợp X.
b) Tính khối lượng muối khan thu được.
c) Lượng khí hiđro ở trên khử vừa đủ 23,2 gam oxit của kim loại M. Xác định CTHH của oxit đó.
Gọi x,y lần lượt là số mol của Al, Fe
nH2 = \(\dfrac{8,96}{22,4}\)=0,4 mol
Pt: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
......x.................................0,5x...........1,5x
.....Fe + H2SO4 --> FeSO4 + H2
.......y..........................y............y
Ta có hệ pt:
{27x+56y=11
1,5x+y=0,4
⇔x=0,2, y=0,1
% mAl = \(\dfrac{0,2.27}{11}\).100%=49,1%
% mFe = \(\dfrac{0,1.56}{11}\).100%=50,9%
mAl2(SO4)3 = 0,5x . 342 = 0,5 . 0,2 . 342 = 34,2 (g)
mFeSO4 = 152y = 152 . 0,1 = 15,2 (g)
Gọi CTTQ: MxOy
Pt: MxOy + yH2 --to--> xM + yH2O
\(\dfrac{0,4}{y}\)<-------0,4
Ta có: 232,2=\(\dfrac{0,4}{y}\)(56x+16y)
⇔23,2=\(\dfrac{22,4x}{y}\)+6,4
⇔\(\dfrac{22,4x}{y}\)=16,8
⇔22,4x=16,8y
⇔x:y=3:4
Vậy CTHH của oxit: Fe3O4
Hỗn hợp X gồm Al và Zn. Hòa tan hoàn toàn 9,2 gam X trong dung dịch H2SO4 loãng, dư, thu được 5,6 lít khí H2 (đktc). Phần trăm khối lượng của Al trong X là
A. 29,35%.
B. 59,75%.
C. 70,65%.
D. 40,25%.