Câu 7. Hoà tan 1,3 gam một kim loại M trong 100 ml dung dịch H2SO4 0,3M. Để trung hoà lượng axit dư cần 200 ml dung dịch NaOH 0,1M. Xác định kim loại M?

Những câu hỏi liên quan
Hòa tan hoàn toàn 0,8 g một kim loại hoá trị II hoà tan hoàn toàn trong 100 ml H 2 S O 4 0,5 M. Lượng axit còn dư phản ứng vừa đủ với 33,4 ml dung dịch NaOH 1,00 M. Xác định tên kim loại.
Số mol H 2 S O 4 trong 100ml dung dịch 0,5M là :
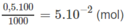
Số mol NaOH trong 33,4 ml nồng độ 1M :
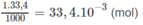
H 2 S O 4 + 2NaOH → N a 2 S O 4 + 2 H 2 O
Lượng H 2 S O 4 đã phản ứng với NaOH :

Số mol H 2 S O 4 đã phản ứng với kim loại là :
5. 10 - 2 - 1.67. 10 - 2 = 3,33. 10 - 2 mol
Dung dịch H 2 S O 4 0,5M là dung dịch loãng nên :
X + H 2 S O 4 → X S O 4 + H 2 ↑
Số mol X và số mol H 2 S O 4 phản ứng bằng nhau, nên :
3,33. 10 - 2 mol X có khối lượng 0,8 g
1 mol X có khối lượng: 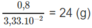
⇒ Mkim loại = 24 g/mol.
Vậy kim loại hoá trị II là magie.
Đúng 0
Bình luận (0)
Hòa tan 1,3g một kim loại R trong 100ml dung dịch H2SO4 0,3M. Để trung hòa lượng axit dư cần 200ml dung dịch NaOH 0,1M. Xác định kim loại R?
\(n_{NaOH} =0,2.0,1 = 0,02(mol)\\ 2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O\\ n_{H_2SO_4\ dư} = \dfrac{1}{2}n_{NaOH} = 0,01(mol)\\ \Rightarrow n_{H_2SO_4\ pư} = 0,1.0,3 - 0,01 = 0,02(mol)\)
Gọi n là hóa trị của kim loại R
\(2R + nH_2SO_4\to R_2(SO_4)_3 + nH_2\\ n_R = \dfrac{2}{n}n_{H_2SO_4} = \dfrac{0,04}{n}(mol)\\ \Rightarrow \dfrac{0,04}{n}.R = 1,3\\ \Rightarrow R = \dfrac{65}{2}n\)
Với n = 2 thì R = 65(Zn)
Đúng 1
Bình luận (1)
1. Hoà tan hoàn toàn 0,575 gam một kim loại kìềm vào nước. Để trung hoà dungdịch thu được cần 25 gam dung dịch HCl 3,65%. Kim loại hoà tan là bao nhiêu?
2. Hoà tan 1,3 gam một kim loại M trong 100 ml dung dịch H 2 SO 4 0,3M. Để trunghoà lượng axit dư cần 200 ml dung dịch NaOH 0,1M. Xác định kim loại M?
3. Ngâm một lá kim loại có khối lượng 50 gam trong dung dịch HCl. Sau khi thuđược 336 ml khí H 2 (đktc) thì khối lượng lá kim loại giảm 1,68%. Kim loại đó là kim loại gì?
4. Đốt một kim loại tr...
Đọc tiếp
1. Hoà tan hoàn toàn 0,575 gam một kim loại kìềm vào nước. Để trung hoà dungdịch thu được cần 25 gam dung dịch HCl 3,65%. Kim loại hoà tan là bao nhiêu?
2. Hoà tan 1,3 gam một kim loại M trong 100 ml dung dịch H 2 SO 4 0,3M. Để trunghoà lượng axit dư cần 200 ml dung dịch NaOH 0,1M. Xác định kim loại M? 3. Ngâm một lá kim loại có khối lượng 50 gam trong dung dịch HCl. Sau khi thuđược 336 ml khí H 2 (đktc) thì khối lượng lá kim loại giảm 1,68%. Kim loại đó là kim loại gì? 4. Đốt một kim loại trong bình chứa khí Clo thu được 32,5 gam muối, đồng thời thể tích khí Clo trong bình giảm 6,72 lít (đktc). Kim loại đem đốt là gì?1) M + H2O -------> MOH + 1/2H2
MOH + HCl --------> MCl + H2O
nHCl = 25*3.65/100*36.5 = 0.025
=> M = 0.575/0.025 = 23 (Na)
Đúng 0
Bình luận (0)
2) 2R + nH2SO4 ===> R2(SO4)n + nH2
.0,04.<............................0,02
H2SO4(dư) + 2NaOH ===> Na2SO4 + 2H2O
....0,01.<........... 0,02
số mol NaOH = 0,1 . 0,2 = 0,02 mol=>số mol H2SO4 (dư) = 0,01
Mà ta có số mol H2SO4 theo đề bài cho là = 0,03mol
====> số mol H2SO4 phản ứng ở phương trình đề tiên = 0,03 - 0,01 = 0,02 mol ==> số mol R = 0,02 mol
Mà ta có khối lượng R = 1.3 gam ==> số mol R cũng = 1,3/R
====> 1,3/R = 0,02 ==> R = 65 ===> R là Zn (kẽm)
Đúng 0
Bình luận (0)
Cho m gam kim loại M hoà tan hoàn toàn trong 100 ml dung dịch HCl 0,1M (D = 1,05 g/ml) được dung dịch X có khối lượng là 105,11 gam. Xác định m và M, biết rằng kim loại có hoá trị từ I đến III.
Khối lượng dung dịch HCl :
m dd = V x D = 100 x 1,05 = 105 (gam)
n HCl = 0,1 x 0,1 = 0,01 (mol)
Gọi hoá trị của kim loại M là n
Phương trình hoá học của phản ứng :
2M + 2nHCl → 2 MCl n + n H 2 (1)
Áp dụng định luật bảo toàn khối lượng
m + m HCl = m muối + m H 2
m = 105,11 + 0,01/2 x 2 - 105 = 0,12g
Theo phương trình hóa học (1) :
n M = 0,01/n mol → 0,01/n x M = 0,12 → M = 12n
Kẻ bảng
| n | 1 | 2 | 3 |
| M | 12 | 24 | 36 |
| loại | nhận | loại |
Vậy kim loại M là Mg.
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 24 gam một kim loại hóa trị 2 trong 750 ml H2SO4 1M. Để trung hòa axit dư trong dung dịch thu được phải dùng hết 150 ml dung dịch NaOH 2M. xác định kim loại
\(n_{NaOH} = 0,15.2 = 0,3(mol)\\ 2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O\\ n_{H_2SO_4\ dư} = \dfrac{1}{2}n_{NaOH} = 0,15(mol)\\ n_{H_2SO_4\ pư} = 0,75 - 0,15 = 0,6(mol)\\ \)
Gọi kim loại cần tìm là R
\(R + H_2SO_4 \to RSO_4 + H_2\\ n_R = n_{H_2SO_4} = 0,6(mol)\\ \Rightarrow M_R = \dfrac{24}{0,6} =40(Ca)\)
Vậy kim loại cần tìm là Canxi
Đúng 2
Bình luận (0)
Cho 1,44g một kim loại R có hoá trị II phản ứng hoàn toàn trong 250ml dung dịch H2SO4 0,3M. Dung dịch thu được còn chứa axit dư và phải trung hoà axit dư bằng 60ml dung dịch NaOH 0,5M. Hãy xác định kim loại R
\(n_{NaOH}=0.06\cdot0.5=0.03\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=\dfrac{0.03}{2}=0.015\left(mol\right)\)
\(n_{H_2SO_4\left(pư\right)}=0.25\cdot0.3-0.015=0.06\left(mol\right)\)
\(R+H_2SO_4\rightarrow RSO_4+H_2\)
\(0.06....0.06\)
\(M_R=\dfrac{1.44}{0.06}=24\left(\dfrac{g}{mol}\right)\)
\(R:Mg\)
Đúng 3
Bình luận (0)
n NaOH = 0,06.0,5 = 0,03(mol)
$2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O$
n H2SO4 dư = 1/2 n NaOH = 0,015(mol)
n H2SO4 pư = 0,25.0,3 - 0,015 = 0,06(mol)
$R + H_2SO_4 \to RSO_4 + H_2$
n R = n H2SO4 pư = 0,06(mol)
M R = 1,44/0,06 = 24(Mg)
Vậy R là Magie
Đúng 3
Bình luận (0)
Hòa tan hoàn toàn 1,44 gam kim loại hóa trị II trong 200 ml dung dịch H2SO4 0,5M. Để trung hòa lượng axit dư phải dùng hết 80 ml dung dịch KOH 1M. Kim loại cần tìm là
A. Magie
B. Canxi
C. Bari
D. Beri
Hòa tan hoàn toàn 1,44 gam kim loại hóa trị II trong 200 mL dung dịch H2SO4 0,5M. Để trung hòa lượng axit dư phải dùng hết 80 mL dung dịch KOH 1M. Kim loại cần tìm là
A. Magie.
B. Canxi.
C. Bari.
D. Beri.
Hòa tan hoàn toàn 1,44 gam kim loại hóa trị II trong 200 mL dung dịch H2SO4 0,5M. Để trung hòa lượng axit dư phải dùng hết 80 mL dung dịch KOH 1M. Kim loại cần tìm là
A. Magie.
B. Canxi.
C. Bari.
D. Beri.
Đáp án A
M + H2SO4 → MSO4 + H2 (1)
2KOH + H2SO4 → K2SO4 + 2H2O (2)
![]()
Mà
![]()
![]()
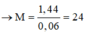
M là Magie
Đúng 0
Bình luận (0)













