Cho 1,92 gam Cu vào 100ml dung dịch chứa đồng thời KNO 3 0,16M và H 2 SO 4 0,4M thấy sinh ra một chất khí có tỉ khối so với H 2 là 15 và dung dịch A. Thể tích khí sinh ra (ở đktc) là
A. 3,584 lít.
B. 0,3584lít.
C. 35,84 lít.
D. 358,4 lít.
Cho 1,92 gam Cu vào 100ml dung dịch chứa đồng thời 0,1M và 0,16M thấy sinh ra một chất khí có tỉ khối so với là 15 và dung dịch A. Thể tích khí sinh ra (ở đktc) là
Khí sinh ra có dkhí/H2 = 15 ⇒ M khí = 15.2 = 30 (g/mol)
→ NO
Ta có: \(n_{Cu}=\dfrac{1,92}{64}=0,03\left(mol\right)\)
\(n_{KNO_3}=0,1.0,1=0,01\left(mol\right)=n_{NO_3^-}\)
\(n_{H_2SO_4}=0,1.0,16=0,016\left(mol\right)\Rightarrow n_{H^+}=0,016.2=0,032\left(mol\right)\)
\(3Cu+8H^++2NO_3^-\rightarrow3Cu^{2+}+2NO+4H_2O\)
⇒ nNO = 0,008 (mol)
⇒ VH2 = 0,008.22,4 = 0,1792 (l)
bài 1: cho 1,92 g Cu vào 100ml dung dịch X gồm KNO3 0,46M và H2SO4 0,4M. Sau phản ứng thoát ra V l khí NO đktc là sản phẩm khử duy nhất . Tính V
Bài 2:HÒa tan 17,4 g FeCO3 trong H2SO4 loãng được dung dịch X. Cần thêm ít nhất bao nhiêu ml dung dịch KNO3 2M vào dung dịch X để thể tích khí NO thoát ra đạt cực đại?
bài 3: cho FeS dư vào 400ml dung dịch HNO3 0,1M được sản phẩm khử duy nhất là NO. Tính THể tích khí NO
3FeS + 12HNO3 => Fe(NO3)3 +Fe2(SO4)3 + 9NO + 6H2O
0,04 ----> 0.03
V= 0,672
Vậy NO=0,672
Cho 1,92 gam bột Cu vào 100 ml dung dịch hỗn hợp X gồm KNO, 0,16 M và H,SO, 0,5 M thu được dung dịch A và khi NO duy nhất. Eể kết tủa toàn bộ Cu2+ trong A cần tối thiểu V lít dung dịch NaOH 0,5 M. Giá trị của V là?
Cho m gam hỗn hợp A gồm Fe và Zn vào 200 ml dung dịch chứa AgNO3 0,18M và Cu(NO3)2 0,12M, sau một thời gian thu được 4,21 gam chất rắn X và dung dịch Y. Cho 1,92 gam bột Mg vào dung dịch Y, sau khi phản ứng xảy ra hoàn toàn, thu được 4,826 gam chất rắn Z và dung dịch T. Giá trị của m là
A. 2,700
B. 3,124
C. 2,648
D. 3,280
Cho m gam hỗn hợp A gồm Fe và Zn vào 200 ml dung dịch chứa AgNO3 0,18M và Cu(NO3)2 0,12M, sau một thời gian thu được 4,21 gam chất rắn X và dung dịch Y. Cho 1,92 gam bột Mg vào dung dịch Y, sau khi phản ứng xảy ra hoàn toàn, thu được 4,826 gam chất rắn Z và dung dịch T. Giá trị của m là
A. 3,280.
B. 2,648.
C. 2,700
D. 3,124.
Đáp án C
Ta có: ![]()
Ta có: ![]()
Bảo toàn điện tích:

Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL:
Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL: ![]()
![]()
Cho m gam hỗn hợp A gồm Fe và Zn vào 200 ml dung dịch chứa AgNO3 0,18M và Cu(NO3)2 0,12M, sau một thời gian thu được 4,21 gam chất rắn X và dung dịch Y. Cho 1,92 gam bột Mg vào dung dịch Y, sau khi phản ứng xảy ra hoàn toàn, thu được 4,826 gam chất rắn Z và dung dịch T. Giá trị của m là
A. 3,2.
B. 3,1.
C. 2,6.
D. 2,7.
Đáp án D
nAgNO3 = 0,036 mol
nCu(NO3)2 = 0,024 mol
Xét cả quá trình phản ứng, ta thấy chỉ có Mg nhường e và Ag+, Cu2+ nhận e.
Bte: 2nMg pư = nAg+ + 2nCu2+ => nMg pư = (0,036 + 2.0,024):2 = 0,042 mol
=> nMg dư = 0,08 – 0,042 = 0,038 mol
Ta có: mX + mY = m + mAg + mCu + mMg dư => 4,21 + 4,826 = m + 0,036.108 + 0,024.64 + 0,038.24
=> m = 2,7 gam
Cho m gam hỗn hợp A gồm Fe và Zn vào 200 ml dung dịch chứa AgNO3 0,18M và Cu(NO3)2 0,12M, sau một thời gian thu được 4,21 gam chất rắn X và dung dịch Y. Cho 1,92 gam bột Mg vào dung dịch Y, sau khi phản ứng xảy ra hoàn toàn, thu được 4,826 gam chất rắn Z và dung dịch T. Giá trị của m là
A. 3,280
B. 2,648
C. 2,700
D. 3,124
Đáp án C
Ta có: ![]()
Ta có: ![]()
Bảo toàn điện tích:
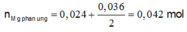
Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL: m = 4,826 - 0,038.24 + 4,21 - 0,036.108 - 0,024.64 = 2,7 gam
Câu 1 : Cho dung dịch NaOH dư vào 100ml dung dịch chứa đồng thời Ba(HCO3)3 0.5 M và BaCl2 0.4 M thì thu được bao nhiêu gam kết tủa ?
Câu 2: Cho m gam Mg vào dung dịch chứa 0.12 mol FeCl3. Sau khi phản ứng xảy ra hoàn toàn thu được 3.36 gam chất rắn. Xác định giá trị của m.
Bài 1 : nBa(2+)=0,1.0,5+0,1.0,4=0,09 mol
nHCO3- = 0,1 mol --> n CO3(2-)=0,1 mol
-->nCO3(2-)>nBa(2+)
nBaCO3 = 0,09 mol
--->mBaCO3=17,73g
Bài 2: Mg + 2FeCl3 --> MgCl2 + 2FeCl2
Mg + FeCl2 --> MgCl2 + Fe
Nếu sau pư Mg dư thì m rắn = mMg dư +mFe = m Mg dư + 56x0.12 = mMg dư + 6.72 > 3.36g
Vậy chất rắn sau pư chỉ có Fe
n = 0.06 mol
nMg = 0.5n FeCl3 + nFe = 0.5x0.12 + 0.06 = 0.12mol
=> m = 2.88g
cho m gam hỗn hợp A gồm Fe và Zn vào 200 ml dung dihcj chwuas AGNO3 0,18M và Cu(NO3)2 0,12M, sau một thời gian thu được 4,21 gam chất rắn X và dung dịch Y. cho 1,92 gam bột Mg vào dung dịch Y, sau khi pư xra htoan, thu đc 4,826 gam chất rắn Z và dd T. giá trị m là:
\(n_{Ag+}=0,036mol, n_{Cu2+}=0,024mol\)
Khối lượng Cu, Ag sinh ra tối đa là 0,036.108+0,024.64=5,424(g) > 4,21 gam
Suy ra hh A tan hết vào trong dung dịch, 4,21g rắn X sinh ra chỉ gồm Ag và có thể có Cu.
Lượng Ag sinh ra tối đa là 0,036.108=3,888 (g) <4,21 gam
suy ra rắn X có 3,888 gam Ag và 4,21-3,888=0,322 gam Cu
Lượng Cu2+ còn lại trong dung dịch Y là 0,024.64-0,322=1,214(g)
Bảo toàn điện tích, ta thấy dd Y có số mol điện dương là \(n_{\left(+\right)ddY}=n_{NO3-}=1.n_{Ag}+2.n_{Cu2+}=0,036+0,024.2=0,084\left(mol\right)\)
Trong khi đó lại cho tới 0,08 mol Mg vào dd Y, nên chắc chắn Mg sẽ dư. suy ra rắn Z gồm toàn bộ m gam hỗn hợp A ban đầu, Cu và Mg dư
\(m_{Mg dư}=24\left(0,08-\frac{0,084}{2}\right)=0,912\left(g\right)\)
Vậy \(m=m_Z-m_{Cu}-m_{Mg dư}=4,826-0,912-1,214=2,7\left(g\right)\)