Cho 20 gam hỗn hợp N a 2 O và CuO tác dụng vừa hết với 3,36 lít S O 2 (đktc). Thành phần phần trăm theo khối lượng của N a 2 O và CuO trong hỗn hợp lần lượt là
A. 46,5% và 53,5%
B. 53,5% và 46,5%
C. 23,25% và 76,75%
D. 76,75% và 23,25%
Chia 64,42 gam hỗn hợp gồm FeO, Fe 3 O 4 , CuO, ZnO, Fe 2 O 3 thành hai phần bằng nhau.
Phần 1 tác dụng hết với axit HCl thu được 59,16 gam muối khan.
Phần 2 tác dụng vừa đủ với 1 lít dung dịch A chứa hỗn hợp HCl và H 2 SO 4 loãng thu được
65,41 gam muối khan.
Tính nồng độ mỗi axit trong dung dịch A.
Giả sử trong mỗi phần có: \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Cu}=b\left(mol\right)\\n_{Zn}=c\left(mol\right)\\n_O=d\left(mol\right)\end{matrix}\right.\)
=> 56a + 64b + 65c + 16d = 32,21
P1:
nO = nH2O = d (mol)
=> nHCl = 2d (mol)
Theo ĐLBTKL: mrắn bđ + mHCl = mmuối + mH2O
=> 32,21 + 73d = 59,16 + 18d
=> d = 0,49 (mol)
P2:
Gọi số mol HCl, H2SO4 là a, b (mol)
nH2O = nO = 0,49 (mol)
Bảo toàn H: a + 2b = 0,98 (1)
Theo ĐLBTKL: mrắn bđ + mHCl + mH2SO4 = mmuối + mH2O
=> 32,21 + 36,5a + 98b = 65,41 + 0,49.18
=> 36,5a + 98b = 42,02 (2)
(1)(2) => a = 0,48 (mol); b = 0,25 (mol)
=> \(\left\{{}\begin{matrix}C_{M\left(HCl\right)}=\dfrac{0,48}{1}=0,48M\\C_{M\left(H_2SO_4\right)}=\dfrac{0,25}{1}=0,25M\end{matrix}\right.\)
Cho 10 gam hỗn hợp X gồm Fe, Fe 2 O 3 , S trong đó O chiếm 24% khối lượng. Hỗn hợp
X tác dụng vừa hết với dung dịch H 2 SO 4 dư sinh ra 1,68 lít khí SO 2 (ở đktc) và dung dịch Y.
Đốt cháy hoàn toàn 10 gam X bằng lượng vừa đủ V lít (đktc) hỗn hợp khí A gồm O 2 và O 3 tỷ lệ
mol 1 : 1. Giá trị của V là?
n O = 10.24%/16 = 0,15(mol)
Quy đổi X gồm n Fe = a(mol) ; n S = b(mol) ; n O = 0,15(mol)
=> 56a + 32b + 0,15.16 = 10(1)
n SO2 = 1,68/22,4 = 0,075(mol)
Bảo toàn electron :
3a + 6b = 0,15.2 + 0,075.2(2)
Từ (1)(2) suy ra a = 0,13 ; b = 0,01
Gọi n O2 = n O3 = x(mol)
Bảo toàn electron :
4n O2 + 6n O3 + 2n O = 3n Fe + 4n S
<=> 4x + 6x + 0,15.2 = 0,13.3 + 0,01.4
<=> x = 0,013
=> V = (0,013 + 0,013).22,4 = 0,5824 lít
Cho 3,36 lít hỗn hợp X gồm CO và H2 tác dụng hết với 40g hỗn hợp Al2O3, CuO, Fe2O3 và Fe3O4 nung nóng. Sau phản ứng thu được m gam chất rắn. Tính m.
nO(mất đi) = \(n_{CO}+n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
=> mrắn(sau pư) = 40 - 0,15.16 = 37,6 (g)
\(n_{hh\left(CO,H_2\right)}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ m_{rắn}=m_{hh.oxit}-0,15.16=40-2,4=37,6\left(g\right)\\ \Rightarrow m=37,6\left(g\right)\)
Bài 14: Cho a gam hỗn hợp A gồm Mg, CuO tác dụng vừa đủ với 500 ml dung dịch HCl 1M thu được 3,36 lít khí H2 ở đktc. Tính a=?
\(n_{HCl}=0.5\cdot1=0.5\left(mol\right)\)
\(n_{H_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(0.15.....0.3........................0.15\)
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
\(0.1.........0.5-0.3\)
\(m_A=0.15\cdot24+0.1\cdot80=11.6\left(g\right)\)
Câu 1
Cho 10 gam hỗn hợp gồm Fe và CuO tác dụng hết với 200 ml dung dịch HCl thu được 3,36 lít khí H2 (ĐCTC)
a)Viết phương trình hóa học
b) tính khối lượng tính chất trong hỗn hợp ban đầu
c) tính nồng độ của HCl đã dùng
Câu 2
Cho 10 g hỗn hợp kim loại Mg và cu tác dụng hết với dung dịch HCl loãng thu được có thể 4,48 lít H2 (điều kiện tiêu chuẩn)
a) Tính thành phần % khối lượng của hỗn hợp
b) tính nồng độ phần % của dung dịch muối sau phản ứng
C1:
nH2= 0,15(mol)
PTHH: Fe + 2 HCl-> FeCl2 + H2
0,15_____0,3______0,15___0,15(mol)
-> mFe= 0,15.56=8,4(g)
-> mCuO= 10-8,4=1,6(g)
b) -> nCuO= 0,02(mol)
PTHH: CuO +2 HCl -> CuCl2 + H2O
0,02_________0,04(mol)
c) nHCl (tổng)= 0,34(mol)
=> CMddHCl= 0,34/0,2=1,7(M)
C2:
a) Mg +2 HCl -> MgCl2 + H2
nH2= 0,2(mol) -> nMg= nMgCl2= nH2=0,2(mol); nHCl=0,4(mol)
mMg= 0,2.24=4,8(g) -> mCu= 5,2(g)
=> %mMg=(4,8/10).100=48%
=>%mCu= 100%-48%=52%
b) mMgCl2= 0,2.95=19(g)
mHCl=0,4.36,5=14,6(g) -> mddHCl= ?? Không cho C% sao tính ta
Cho 8,5 gam hỗn hợp Na và K tác dụng hết với nước thu được 3,36 lít khí H 2 (đktc) và dung dịch X. Cho X tác dụng vừa đủ với dung dịch F e 2 S O 4 3 thu được m gam kết tủa. Giá trị của m là
A. 5,35
B. 16,05
C. 10,70
D. 21,40
Cho 8,50 gam hỗn hợp Na và K tác dụng hết với nước thu được 3,36 lít khí H2 (đktc) và dung dịch X. Cho X tác dụng vừa đủ với dung dịch Fe2(SO4)3 thu được m gam kết tủa. Giá trị của m là:
A.5,35.
B.16,05.
C. 10,70.
D. 21,40.
Đáp án C
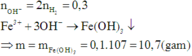
Nhận xét:Ở bài này, giả thiết cho thừa dữ kiện về tổng khối lượng hai kim loại. Đề bài sẽ hay hơn khi thay một trong hai kim loại kiềm trong hỗn hợp bằng kim loại Ba, khi đó kết tủa tạo thành gồm Fe(OH)3 và BaSO4. Để tính n F e ( O H ) 3 ta vẫn có cách làm như trên, tuy nhiên để tính được n B a S O 4 thì ta cần biết nBa , khi đó ta cần lập và giải hệ 2 phương trình bậc nhất 2 ẩn là nBa và nNa (hoặc nK ) theo giả thiết về khối lượng và n H 2 .
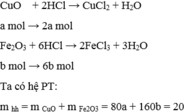
Cho 20 gam hỗn hợp X gồm CuO và F e 2 O 3 tác dụng vừa đủ với 0,2 lít dung dịch HCl có nồng độ 3,5M. Thành phần phần trăm theo khối lượng của CuO và F e 2 O 3 trong hỗn hợp X lần lượt là :
A. 25% và 75%
B. 20% và 80%
C. 22% và 78%
D. 30% và 70%
Chọn B
Gọi a là số mol của CuO và b là số mol của F e 2 O 3 có trong 20 gam
hh 200 ml dd HCl 3,5 M => nHCl = 0,2 . 3,5 = 0,7 mol
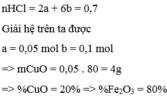
Cho 3,36 lít khí CO (đktc) phản ứng vừa đủ với 20 gam hỗn hợp X gồm CuO và MgO. Phần trăm khối lượng của MgO trong X là
A. 80%
B. 60%.
C. 20%.
D. 40%.