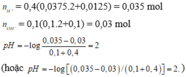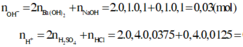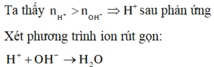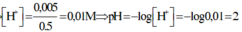Bài 1: Nhận biết các chất sau:
a, Các dd: NH4Cl; Na2SO4; (NH4)2SO4; NH4NO3
b, Các khí: HCl, CO2, NH3, N2
Bài 2: Trộn 100ml dd (gồm Ba(OH)2 0,1M và NaOH 0,1M) với 400ml dd (gồm H2SO4 0,0375M và HCl 0,0125M) thu được m gam kết tủa và dung dịch X. Tính giá trị của m, CM các ion trong X và pH của dd X.
Bài 3: Trộn 250ml dd hỗn hợp gồm HCl 0,08M và H2SO4 0,01M với 250ml dd Ba(OH)2 aM thu được m gam kết tủa và 500ml dd X có pH =12. Cô cạn dd X được b gam chất rắn khan. Tính m, a và b?