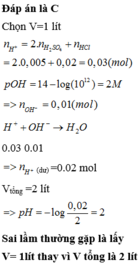Trộn lẫn 15 ml dung dịch NaOH 2 m và 10 ml dung dịch H2 SO4 1,5 m Tính pH của dung dịch thu được

Những câu hỏi liên quan
trộn lẫn 15 ml dung dịch NaOH 2 mol và 10 ml dung dịch h2 SO4 1,5 mol cho biết dung dịch thu được cần dư axit dư bazơ hay trung tính
Bài 2: Trộn lẫn 300ml dung dịch HCl 0,2M với 200ml dung dịch H2SO4 0,05M thu được dung dịch X. Tính pH của dung dịch X. Bài 3:Trộn lẫn 150 ml dung dịch NaOH 2M với 200 ml dung dịch H2SO4 1M, thu được dung dịch X. Tính giá trị pH dung dịch X.Bài 4: Cho 200 ml dung dịch NaHCO3 1M tác dụng với dung dịch Ba(OH)2 dư thu được m gam kết tủa trắng. Tìm giá trị của m.Bài 5: Hòa tan hết 9,9 gam Zn(OH)2 cần vừa đủ V ml dung dịch HCl 2M. Tìm giá trị của V.
Đọc tiếp
Bài 2: Trộn lẫn 300ml dung dịch HCl 0,2M với 200ml dung dịch H2SO4 0,05M thu được dung dịch X. Tính pH của dung dịch X.
Bài 3:Trộn lẫn 150 ml dung dịch NaOH 2M với 200 ml dung dịch H2SO4 1M, thu được dung dịch X. Tính giá trị pH dung dịch X.
Bài 4: Cho 200 ml dung dịch NaHCO3 1M tác dụng với dung dịch Ba(OH)2 dư thu được m gam kết tủa trắng. Tìm giá trị của m.
Bài 5: Hòa tan hết 9,9 gam Zn(OH)2 cần vừa đủ V ml dung dịch HCl 2M. Tìm giá trị của V.
Trộn lẫn 300 ml dung dịch KOH 1m với 700 ml dung dịch HCl 1,5 m thì thu được dung dịch D a Tính nồng độ mol của các ion có trong dung dịch D b) tính thể tích dung dịch Ba(OH)2 1,5 m để trung hòa hoàn toàn dung dịch D
a)
$KOH + HCl \to KCl + H_2O$
$n_{KOH} = 0,3(mol) < n_{HCl} = 1,05(mol)$ nên HCl dư
$n_{HCl\ dư} = 1,05 -0 ,3 = 0,75(mol)$
$n_{KCl} = n_{KOH} = 0,3(mol)$
$V_{dd} = 0,3+ 0,7 = 1(lít)$
Suy ra :
$[K^+] = \dfrac{0,3}{1} = 0,3M$
$[Cl^-] = \dfrac{0,75 + 0,3}{1} = 1,05M$
$[H^+] = \dfrac{0,75}{1} = 0,75M$
b)
$Ba(OH)_2 + 2HCl \to BaCl_2 + 2H_2O$
$n_{Ba(OH)_2} = \dfrac{1}{2}n_{HCl} = 0,375(mol)$
$V_{Ba(OH)_2} = \dfrac{0,375}{1,5} = 0,25(lít)$
Đúng 3
Bình luận (0)
\(n_{KOH}=0.3\cdot1=0.3\left(mol\right)\)
\(n_{HCl}=0.7\cdot1.5=1.05\left(mol\right)\)
\(KOH+HCl\rightarrow KCl+H_2O\)
\(0.3...........0.3..........0.3\)
Dung dịch D gồm : 0.3 (mol) KCl , 0.75 (mol) HCl dư
\(\left[K^+\right]=\dfrac{0.3}{0.3+0.7}=0.3\left(M\right)\)
\(\left[Cl^-\right]=\dfrac{0.3+0.75}{0.3+0.7}=1.05\left(M\right)\)
\(\left[H^+\right]=\dfrac{0.75}{0.3+0.7}=0.75\left(M\right)\)
\(Ba\left(OH\right)_2+2HCl\rightarrow BaCl_2+2H_2O\)
\(0.375..................0.75\)
\(V_{dd_{Ba\left(OH\right)_2}}=\dfrac{0.375}{1.5}=0.25\left(l\right)\)
Đúng 3
Bình luận (0)
Mọi người giải giúp mk đc ko ạCâu 1: Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03M, thu được 2V ml dung dịch Y. Dung dịch Y có pH bằngCâu 2: Khi trộn những thể tích bằng nhau của dung dịch HNO3 0,01M và dung dịch NaOH 0,03M thì thu được dung dịch có giá trị pH bằng Câu 3: Trộn 100 ml dung dịch gồm Ba(OH)2 0,1M và NaOH 0,1M với 400 ml dung dịch gồm H2SO4 0,0375M và HCl 0,0125M thu được dung dịch X. Giá trị pH của dung dịch X làCâu 4: Hòa tan m gam Na vào nước được 100 ml dung...
Đọc tiếp
Mọi người giải giúp mk đc ko ạ
Câu 1: Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03M, thu được 2V ml dung dịch Y. Dung dịch Y có pH bằng
Câu 2: Khi trộn những thể tích bằng nhau của dung dịch HNO3 0,01M và dung dịch NaOH 0,03M thì thu được dung dịch có giá trị pH bằng
Câu 3: Trộn 100 ml dung dịch gồm Ba(OH)2 0,1M và NaOH 0,1M với 400 ml dung dịch gồm H2SO4 0,0375M và HCl 0,0125M thu được dung dịch X. Giá trị pH của dung dịch X là
Câu 4: Hòa tan m gam Na vào nước được 100 ml dung dịch có pH = 13. Giá trị của m bằng
Câu 5: Để trung hoà 100 gam dung dịch HCl 1,825% cần bao nhiêu ml dung dịch Ba(OH)2 có pH bằng 13?
Câu 6: Trộn 200 ml dung dịch hỗn hợp gồm HNO3 0,3M và HClO4 0,5M với 200 ml dung dịch Ba(OH)2 aM, thu được dung dịch có pH = 3. Vậy a có giá trị là
Câu 7: Trộn 100 ml dung dịch có pH=1 gồm HCl và HNO3 với 100 ml dung dịch NaOH nồng độ a (mol/l), thu được 200 ml dung dịch có pH=12. Giá trị của a
Câu 8: Trộn 250 ml dung dịch chứa hỗn hợp HCl 0,08M và H2SO4 0,01M với 250 ml dung dịch NaOH aM thu được 500 ml dung dịch có pH = 12. Giá trị a là
Câu 9: Trộn 3 dung dịch H2SO4 0,1M, HCl 0,2M và HNO3 0,3M với thể tích bằng nhau, thu được dung dịch X. Cho 300 ml dung dịch X tác dụng với V lít dung dịch Y chứa NaOH 0,2M và Ba(OH)2 0,1M được dung dịch Z có pH = 1. Giá trị của V là
Câu 10: Trộn 100ml dd H2SO4 0,01M với 400ml dd Ba(OH)2 nồng độ a mol/l thu được m gam kết tủa và dd còn lại có pH=12. Giá trị của m và a là
Câu 11: Trộn 300ml dd HCl 0,05M với 200ml dd Ba(OH)2 nồng độ a mol/l thu được 500ml dd có pH=x. Cô cạn dd sau phản ứng thu được 1,9875 gam chất rắn. Giá trị của a và x lần lượt là
Câu 12: Trộn 150 ml dd HCl nồng độ a mol/l với 250 ml dd hỗn hợp gồm NaOH 0,5M và Ba(OH)2 0,1M thu được dd có pH=12. Giá trị của a là
Câu 13: Trộn 250 ml dd hỗn hợp gồm HCl 0,08M và H2SO4 0,01M với 250 ml dd NaOH nồng độ b mol/l được 500 ml dd có pH=12. Giá trị của b là
Câu 14: Trộn 250 ml dd hỗn hợp gồm HCl 0,08M và H2SO4 0,01M với 250 ml dd Ba(OH)2 nồng độ x mol/l thu được m gam kết tủa và 500 ml dd có pH=12 . Giá trị của m và x tương ứng là
Câu 1: nOH-=0,01V(mol) nH+ =0,03V(mol)
nOH-<nH+ nên axit dư -->nH+dư =0,02V(mol)--->CM H+=0,01(M)=10-2->pH=2
Chú thích do thể tích như nhau nên ko cần đổi
Câu 2:nOH-=0,03a(mol) nH+=0,01a(mol)-->OH-dư
noh-dư=0,02a(mol) mà v=2a-->Cm oh-=0,01=10-2(M)->pH=12
Câu 3:nOH-=0,03 nH+=0,035->H+dư nH+dư=0,005 mol
V=0,5(l) CmH+=10^-2 pH=2
Đúng 0
Bình luận (0)
Trộn 100 ml dung dịch H2 SO4 0,2 M với 100 ml dung dịch NaOH 0,1 m tính các ion sau khi trộn tính pH của dung dịch đó
Trộn lẫn V ml dung dịch (gồm NaOH và Ba(OH)2) có pH = 12 với V ml dung dịch gồm HCl 0,02 M và H2SO4 0,005M được 2V ml dung dịch Y. Dung dịch Y có pH là
A. 3
B. 4
C. 2
D. 1
Trộn lẫn 30 ml dung dịch NaOH 2M và 20 ml dung dịch H2SO41,5 M. Vậy dung dịch thu được có tính:A.Axit B.Bazơ C.Trung hoà D.Lưỡng tính
Đọc tiếp
Trộn lẫn 30 ml dung dịch NaOH 2M và 20 ml dung dịch H2SO41,5 M. Vậy dung dịch thu được có tính:
A.Axit
B.Bazơ
C.Trung hoà
D.Lưỡng tính
Trộn lẫn 150 ml dung dịch NaOH 2M với 200 ml dung dịch H2SO4 1M, thu được dung dịch X. Tính giá trị pH dung dịch X.
\(n_{OH^-}=0,15.2=0,3\left(mol\right)\)
\(n_{H^+}=0,2\left(mol\right)\)
\(\Rightarrow n_{OH^-dư}=0,1\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]=\dfrac{0,1}{0,35}=\dfrac{2}{7}M\)
\(\Rightarrow\left[H^+\right]=3,5.10^{-14}M\)
\(\Rightarrow pH\approx13,46\)
Đúng 0
Bình luận (0)
Trộn lẫn 100 ml dung dịch HCl 1M với 200 ml dung dịch Al2(SO4)3 0,1M thu được dung dịch X. Thêm từ từ 0,125 mol Ba(OH)2 vào dung dịch X thu được m gam kết tủa. Giá trị của m là A. 15,54 B. 17,10 C. 14,76 D. 13,98
Đọc tiếp
Trộn lẫn 100 ml dung dịch HCl 1M với 200 ml dung dịch Al2(SO4)3 0,1M thu được dung dịch X. Thêm từ từ 0,125 mol Ba(OH)2 vào dung dịch X thu được m gam kết tủa. Giá trị của m là
A. 15,54
B. 17,10
C. 14,76
D. 13,98
• 0,1 mol HCl + 0,02 mol Al2(SO4)3 → ddX
ddX + 0,125 mol Ba(OH)2 → ↓
• 2HCl + Ba(OH)2 → BaCl2 + 2H2O (*)
Al2(SO4)3 + 3Ba(OH)2 → 2Al(OH)3↓ + 3BaSO4↓ (**)
2Al(OH)3 + Ba(OH)2 → Ba(AlO2)2 + 4H2O (***)
Theo (*) nBa(OH)2 = 0,1 : 2 = 0,05 mol.
Theo (**) nBa(OH)2 = 0,02 × 3 = 0,06 mol; nAl(OH)3 = 0,04 mol; nBaSO4 = 0,06 mol.
Theo (***) nBa(OH)2 = 0,125 - 0,05 - 0,06 = 0,015 mol → nAl(OH)3 = 0,04 - 0,015 × 2 = 0,01 mol.
→ m↓ = mBaSO4 + mAl(OH)3 = 0,06 × 233 + 0,01 × 78 = 14,76 gam
→ Đáp án đúng là đáp án C
Đúng 0
Bình luận (0)