Cho dung dịch chứa 0,1 mol (NH4)2CO3 tác dụng với dung dịch chứa 34,2 gam Ba(OH)2. Sau phản ứng thu được m gam kết tủa.
a) Viết phương trình phân tử, phương trình ion rút gọn.
b) Tính khối lượng kết tủa thu được.
Cho dung dịch chứa 0,1 mol (NH4)2CO3 tác dụng với dung dịch chứa 34,2 gam Ba(OH)2. Sau phản ứng thu được m gam kết tủa. Giá trị của m là
A. 19,7
B. 39,4
C. 17,1
D. 15,5
Cho dung dịch chứa 0,1 mol (NH4)2CO3 tác dụng với dung dịch chứa 34,2 gam Ba(OH)2. Sau phản ứng thu được m gam kết tủa. Giá trị của m là
A. 19,7
B. 39,4
C. 17,1
D. 15,5
Cho dung dịch chứa 0,1 mol (NH4)2CO3 tác dụng với dung dịch chứa 34,2 gam Ba(OH)2. Sau phản ứng thu được m gam kết tủa. Giá trị của m là:
A. 19,7
B. 39,4
C. 17,1
D. 15,5
Đáp án A
(NH4)2CO3 + Ba(OH)2→ BaCO3↓ + 2NH3+ 2H2O
0,1 mol 0,2 mol 0,1 mol
mBaCO3= 0,1.197= 19,7 gam
Cho dung dịch chứa 0,1 mol (NH4)2CO3 tác dụng với dung dịch chứa 34,2 gam Ba(OH)2. Sau phản ứng thu được m gam kết tủa. Giá trị của m là
A. 19,7
B. 39,4
C. 17,1
D. 15,5
Cho 250g dung dịch Ba(OH)2 34,2% tác dụng với 150 gam dung dịch H2SO4 4,9%. Tính khối lượng kết tủa thu được
cho 250 g dung dich ba(oh)2 34,2% tác dụng với 150 gam dung dịch h2so4 4,9%
a, tính khối lượng kết tủa thu được
b, tính c% sau phản ứng
Ta có: \(C_{\%_{Ba\left(OH\right)_2}}=\dfrac{m_{Ba\left(OH\right)_2}}{250}.100\%=34,2\%\)
=> \(m_{Ba\left(OH\right)_2}=85,5\left(g\right)\)
=> \(n_{Ba\left(OH\right)_2}=\dfrac{85,5}{171}=0,5\left(mol\right)\)
Ta lại có: \(C_{\%_{H_2SO_4}}=\dfrac{m_{H_2SO_4}}{150}.100\%=4,9\%\)
=> \(m_{H_2SO_4}=7,35\left(g\right)\)
=> \(n_{H_2SO_4}=\dfrac{7,35}{98}=0,075\left(mol\right)\)
a. PTHH; Ba(OH)2 + H2SO4 ---> BaSO4↓ + 2H2O
Ta thấy: \(\dfrac{0,5}{1}>\dfrac{0,075}{1}\)
Vậy Ba(OH)2 dư.
Theo PT: \(n_{BaSO_4}=n_{H_2SO_4}=0,075\left(mol\right)\)
=> \(m_{BaSO_4}=0,075.233=17,475\left(g\right)\)
b. Ta có: \(m_{dd_{BaSO_4}}=250+7,35=257,35\left(g\right)\)
=> \(C_{\%_{BaSO_4}}=\dfrac{17,475}{257,35}.100\%=6,79\%\)
Cho 34,2 g Ba(OH)2 vào 240 gam dung dịch Na2SO4. a) Viết phương trình phản ứng xảy ra. b) Tính khối lượng kết tủa thu được. c) Tính nồng độ phần trăm của dung dịch Na2SO4 đã dùng
Ta có: \(n_{Ba\left(OH\right)_2}=\dfrac{34,2}{171}=0,2\left(mol\right)\)
a. PTHH: \(Ba\left(OH\right)_2+Na_2SO_4--->BaSO_4\downarrow+2NaOH\)
b. Theo PT: \(n_{BaSO_4}=n_{Ba\left(OH\right)_2}=0,2\left(mol\right)\)
=> \(m_{BaSO_4}=0,2.233=46,6\left(g\right)\)
c. Theo PT: \(n_{Na_2SO_4}=n_{Ba\left(OH\right)_2}=0,2\left(mol\right)\)
=> \(m_{Na_2SO_4}=0,2.142=28,4\left(g\right)\)
=> \(C_{\%_{Na_2SO_4}}=\dfrac{28,4}{240}.100\%=11,83\%\)
cho hỗn hợp chứa 0,2 mol Cu va 0,1 mol Fe3O4 vao 400 ml dung dịch HCl 2M.phản ứng kết thúc thu được dung dịch A và còn lại là a gam chất rắn B không tan.cho A tác dụng với dung dịch NaOH dư rồi đun nóng trong không khí.sau đó lọc lấy kết tủa nung đến khối lượng không đổi thu đc b gam chất rắn C .cho các phản ứng xảy ra hoàn toàn.......viết các phương trình phản ứng xảy ra và tính giá trị a , b
cho 0,5 lít dung dịch koh 0,2M tác dụng với dung dịch có chứa 14,25 gam MgCl2
a. viết phương trình hh
b. tính khối lượng kết tủa sau phản ứng
\(n_{KOH}=0,5\cdot0,2=0,1mol\)
\(n_{MgCl_2}=\dfrac{14,25}{95}=0,15mol\)
\(2KOH+MgCl_2\rightarrow Mg\left(OH\right)_2\downarrow+2KCl\)
0,1 0,15 0,05
số mol kết tủa tính theo KOH do KOH hết.
\(m_{Mg\left(OH\right)_2}=0,05\cdot58=2,9\left(g\right)\)
Một dung dịch có chứa các ion: NH 4 + (0,1 mol), K + (0,15 mol), NO 3 - (0,1 mol), và CO 3 2 - (x mol). Cho dung dịch X tác dụng với lượng dư dung dịch BaCl 2 thu được m gam kết tủa. Giá trị của m là
A. 9,85.
B. 14,775.
C. 19,7.
D. 16,745.
Chọn B
Bảo toàn điện tích có: 0,1 + 0,15 = 0,1 + 2x → x = 0,075 mol
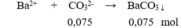
m↓ = 0,075.197 = 14,775 gam.