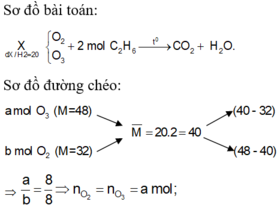
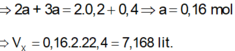tính số mol của 4,48 lít H2 hỗn hợp khí X gồm O2 và O3

Những câu hỏi liên quan
a, Tính khối lượng của 2,5 mol CuO b, Tính số mol của 4,48 lít khí CO2 (đktc) c, Tính khối lượng của 4,48 lít khí SO2 (đktc) d, Khối lượng hỗn hợp khí ở đktc gồm 11,2 lít H2 và 5,6 lít O2 là:
a, khối lượng của 2,5 mol CuO là:
\(m=n.M=2,5.80=200\left(g\right)\)
b, số mol của 4,48 lít khí CO2 (đktc) là:
\(n=\dfrac{V}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Đúng 1
Bình luận (0)
b.nCO2=V/22,4=4,48:22,4=0,2 mol
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Hỗn hợp X gồm O2 và O3 có tỉ khối so với H2 bằng 20. Để đốt cháy hoàn toàn 4,48 lít khí CH4 cần V lít hỗn hợp khí X. Các khí đo ở điều kiện tiêu chuẩn. Gía trị của V là: A. 3,584 lit B. 4,480 lit C. 8,960 lit D. 7,168 lit
Đọc tiếp
Hỗn hợp X gồm O2 và O3 có tỉ khối so với H2 bằng 20. Để đốt cháy hoàn toàn 4,48 lít khí CH4 cần V lít hỗn hợp khí X. Các khí đo ở điều kiện tiêu chuẩn. Gía trị của V là:
A. 3,584 lit
B. 4,480 lit
C. 8,960 lit
D. 7,168 lit
1. Hỗn hợp khí X gồm O2 và CO2 có tỉ khối hơi so với hidro là 18. Tính số mol mỗi có trong 4,48 lít hỗn hợp khí X (đktc)
2. Tính số mol mỗi khí có trong 5,6 lít (đktc) hỗn hợp khí A gồm O2 và NO2 có tỉ khối so với hidro là 17,4
Đặt \(n_{O_2}=x;n_{CO_2}=y\)
\(n_X=\dfrac{4,48}{22,4}=0,2\left(mol\right)\Leftrightarrow x+y=0,2\)
Ta có: \(16x+44y=\left(x+y\right).18.2\)
\(\Leftrightarrow2y=5x\)
\(\Leftrightarrow\dfrac{y}{5}=\dfrac{x}{2}\)
Mà x+y=0,2
\(\Rightarrow\dfrac{y}{5}=\dfrac{x}{2}=\dfrac{x+y}{5+2}=\dfrac{0,2}{7}=0,0286\)
\(\Rightarrow y=5.0,0286=0,143\left(mol\right);x=0,2-0,143=0,057\left(mol\right)\)
Đúng 1
Bình luận (0)
Hỗn hợp X gồm O2 và O3 có tỉ khối so với hiđro là 19,2. Hỗn hợp Y gồm H2 và CO. Đốt cháy hoàn toàn 3 mol khí Y cần vừa đủ V lít hỗn hợp X. Giá trị của V là A. 28 B. 22,4 C. 16,8 D. 9,318
Đọc tiếp
Hỗn hợp X gồm O2 và O3 có tỉ khối so với hiđro là 19,2. Hỗn hợp Y gồm H2 và CO. Đốt cháy hoàn toàn 3 mol khí Y cần vừa đủ V lít hỗn hợp X. Giá trị của V là
A. 28
B. 22,4
C. 16,8
D. 9,318
tính số mol của 4,48 lít H2 hỗn hợp khí X gồm O2 và O3
4,48 lít hỗn hợp (Z) gồm O2 và Cl2 ở đktc.Tỉ khối của (Z) đối với khí H2 là 30,625.
a,Tính % theo thể tích mỗi khí trong hỗn hợp
b, Tính số mol mỗi khí trong hỗn hợp
giải dùm mình cần gấp tối nay lúc 9h giúp dùm mình
a,
nZn=4,4822,4=0,2mol
Gọi a là mol O2, b là mol Cl2
=> a+b=0,2 (1)
MZ= 30,625.2= 61,25
=> 32a+71b\0,2= 61,25
=> 32a+71b=12,25 (2)
(1)(2) => a= 0,05; b= 0,15
b,
%VO2=0,05.100\0,2=25%
=> %VCl2=75%
Đúng 1
Bình luận (0)
Hỗn hợp khí A gồm có
O
2
và
O
3
tỉ khối của hỗn hợp khí A đối với khí
H
2
là 19,2. Hỗn hợp khí B gồm có
H
2
và khí CO, tỉ khối của hỗn hợp khí B đối với
H
2...
Đọc tiếp
Hỗn hợp khí A gồm có O 2 và O 3 tỉ khối của hỗn hợp khí A đối với khí H 2 là 19,2. Hỗn hợp khí B gồm có H 2 và khí CO, tỉ khối của hỗn hợp khí B đối với H 2 là 3,6.
Một mol khí A có thể đốt cháy hoàn toàn bao nhiêu mol khí CO ?
PTHH của các phản ứng :
2CO + O 2 → 2C O 2 (1)
3CO + O 3 → 3C O 2 (2)
Trong 1 mol hỗn hợp khí A có 0,6 mol O 3 và 0,4 mol O 2
Theo (1): 0,6 mol O 2 đốt cháy được 1,2 mol CO.
Theo (2) : 0,4 mol O 3 đốt cháy được 1,2 mol CO.
Kết luận : 1 mol hỗn hợp khí A đốt cháy được 2,4 mol khí CO.
Đúng 1
Bình luận (1)
Hỗn hợp khí X gồm
O
2
và
O
3
, tỉ khối của X so với
H
2
là 17,6. Hỗn hợp khí Y gồm
C
2
H
4
và
CH
4
, tỉ khối của Y so với
H
2
là 11. Thể tích hỗn hợp khí X (đ...
Đọc tiếp
Hỗn hợp khí X gồm O 2 và O 3 , tỉ khối của X so với H 2 là 17,6. Hỗn hợp khí Y gồm C 2 H 4 và CH 4 , tỉ khối của Y so với H 2 là 11. Thể tích hỗn hợp khí X (đktc) tối thiểu cần dùng để đốt cháy hoàn toàn 0,044 mol hỗn hợp khí Y là :
A. 3,36 lít
B. 2,24 lít
C. 1,12 lít
D. 4,48 lít
Đáp án B
Nhận thấy :
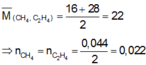
Quy đổi O2 và O3 thành O. Theo bảo toàn electron và bảo toàn khối lượng, ta có :
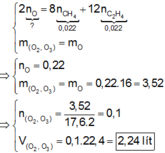
Đúng 1
Bình luận (0)
đôt cháy hoàn toàn hỗn hợp khí gồm co và h2 cần dùng 6,72 lít khí o2.thu được 4,48 lít co2.tính phần trăm theo khối lượng và thể tích của hỗn hợp ban đầu
\(2CO + O_2 \xrightarrow{t^o} 2CO_2(1)\\ 2H_2 + O_2 \xrightarrow{t^o} 2H_2O(2)\\ n_{CO} = n_{CO_2} = \dfrac{4,48}{22,4} = 0,2(mol)\\ n_{O_2(1)} = \dfrac{n_{CO_2}}{2} = 0,1(mol)\\ \Rightarrow n_{H_2} = 2n_{O_2(2)} = 2.(\dfrac{6,72}{22,4}-0,1)=0,4(mol)\\ \%V_{CO} = \dfrac{0,2}{0,2+0,4}.100\% = 33,33\%\\ \%V_{H_2} = 100\% -33,33\% = 66,67\%\)
\(\%m_{CO} = \dfrac{0,2.28}{0,2.28+0,4.2}.100\% = 87,5\%\\ \%m_{H_2} = 100\% - 87,5\% = 12,5\%\)
Đúng 1
Bình luận (0)