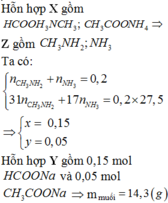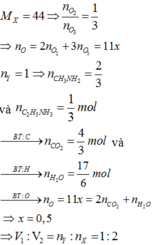Tính tỉ khối của hhA đối với hhB biết VA=VB,A gồm C3H8 và C4H8,B gồm N2 và C2H4

Những câu hỏi liên quan
Một hợp chất x có thành phần gồm 2 nguyên tố C và O.Biết tỉ lệ khối lượng của C đối với O là mC.mO=3:8.Xác định CTHH của x
Cho hỗn hợp X gồm hai chất hữu cơ có cùng công thức phân tử C2H7NO2 tác dụng vừa đủ với dung dịch NaOH và đun nóng, thu được dung dịch Y và 4,48 lít hỗn hợp Z (ở đktc) gồm hai khí ( đều làm xanh giấy quỳ ẩm). Tỉ khối hơi của Z đối với H2 bằng 13,75. Cô cạn dung dịch Y thu được khối lượng muối khan là A. 14,3 gam B. 16,5 gam. C. 15,7 gam D. 8,9 gam
Đọc tiếp
Cho hỗn hợp X gồm hai chất hữu cơ có cùng công thức phân tử C2H7NO2 tác dụng vừa đủ với dung dịch NaOH và đun nóng, thu được dung dịch Y và 4,48 lít hỗn hợp Z (ở đktc) gồm hai khí ( đều làm xanh giấy quỳ ẩm). Tỉ khối hơi của Z đối với H2 bằng 13,75. Cô cạn dung dịch Y thu được khối lượng muối khan là
A. 14,3 gam
B. 16,5 gam.
C. 15,7 gam
D. 8,9 gam
đốt cháy 23g chất hữu cơ A thu được sản phẩm gồm 44g Co2 và 27g nước
a,Trong A có những nguyên tố nào ?
b, Xác định công thức phân tử của A . Biết tỉ khối của A so với hiđro là 23
a, Bảo toàn C: \(n_C=n_{CO_2}=\dfrac{44}{44}=1\left(mol\right)\)
Bảo toàn H: \(n_H=2n_{H_2O}=2.\dfrac{27}{18}=3\left(mol\right)\)
Bảo toàn O: \(n_O=\dfrac{23-3-12}{16}=0,5\left(mol\right)\)
A có chứa C, H và O
b, \(M_A=23.2=46\left(\dfrac{g}{mol}\right)\)
\(CTPT:C_xH_yO_z\\ x:y:z=1:3:0,5=2:6:1\\ CTPT:C_2H_6O\)
Đúng 2
Bình luận (0)
Hỗn hợp X gồm C3H8 và C3H6 có tỉ khối so với hiđro là 21,8. Đốt cháy hết 5,6 lít X (đktc) thì thu được bao nhiêu gam CO2 và bao nhiêu gam H2O? A. 33g và 17,1g B. 22g và 9,9g C. 13,2g và 7,2g D. 33g và 21,6g
Đọc tiếp
Hỗn hợp X gồm C3H8 và C3H6 có tỉ khối so với hiđro là 21,8. Đốt cháy hết 5,6 lít X (đktc) thì thu được bao nhiêu gam CO2 và bao nhiêu gam H2O?
A. 33g và 17,1g
B. 22g và 9,9g
C. 13,2g và 7,2g
D. 33g và 21,6g
Đáp án A
Hướng dẫn
C3H6 + 9/2O2 → 3CO2 + 3H2O
C3H8 + 5O2 → 3CO2 + 4H2O
nX = 0,25 mol => nCO2 = 0,25.3 = 0,75 mol; mCO2 = 0,75.44 = 33 gam
mX = mC + mH
<=> 21,8.2.0,25 = 0,75.12 + 2.nH2O
=> nH2O = 0,95mol
mH2O = 18.0,95 = 17,1 gam
Đúng 0
Bình luận (0)
Hỗn hợp A gồm N2, H2, NH3 ( và một ít chất xúc tác ) có tỉ khối so với H2 bằng 6,05. Nung nóng A một thời gian thấy tỉ khối hỗn hợp so với H2 tăng 0,348. Vậy hiệu suất tạo khí NH3 là :
A.10% B.18,75% C.34% D.27%
Hỗn hợp X gồm Cu và Fe có tỉ lệ khối lượng tương ứng là 7 : 3. Lấy m gam X phản ứng hoàn toàn với dung dịch chứa 0,7 mol HNO3. Sau phản ứng còn lại 0,75m gam chất rắn và có 0,25 mol khí Y gồm NO và NO2. Giá trị của m là:
A. 40,5
B. 50,4
C. 50,2
D. 50
Đáp án B
Ta có:
![]()
mCu = 0,7m (g)
Vì Fe phản ứng trước Cu và sau khi phản ứng còn 0,75m (g) chất rắn → Cu chưa phản ứng 0,7m
Fe dư 0,75m - 0,7m = 0,05m → mFe pư = 0,2m - 0,05m = 0,25m (g)
Fe dư → Chỉ tạo muối Fe(NO3)2
HNO3 hết (Lưu ý chỉ H+ hết, NO3- còn trong muối).
Quá trình nhường electron:

Quá trình nhận electron:
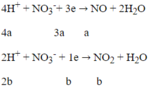
Áp dụng định luật bảo toàn electron:
![]()
→ m = 50,4
Đúng 0
Bình luận (0)
mọi người ơi giải giúp mình theo cách của lớp 9 với nha
Đốt cháy x mol Fe bởi oxi thu được 5,04 gam hỗn hợp A gồm các oxit sắt. Hoà tan hoàn toàn A trong dung dịch HNO3 nóng dư thu được 0,035 mol hỗn hợp Y gồm NO và NO2. Tỉ khối của Y đối với H2 là 19. Tính x.
M(Y)=19x2=38(đvC) =>nNO=nNO2=0,0175(mol)
BTe:3x=4nO2+0,0175.3+0,0175.1
=>nO2=(3x-0,07)/4
BTKL: mFe+mO2=m(A) <=> 56x+(3x-0,07).32/4=5,04
<=> x=0,07 (mol )
Hỗn hợp A gồm SO2 và O2 có tỷ khối đối với H2 = 24 sau khi nung nóng vs V2O5 thu được hỗn hợp khí B có tỷ khối hơi đối với H2 là 30
a) Tính % thể tích mỗi khí trước và sau phản ứng
b)Tính% khối lượng về mỗi khí tham gia phản ứng
c) Tính H% phản ứng
Cho hỗn hợp X gồm O2, O3 có tỉ khối so với H2 bằng 22. Cho hỗn hợp Y gồm metylamin và etylamin có tỉ khối so với H2 17,8333. Đốt hoàn toàn V2 lít Y cần V1 lít X. Các khí đo cùng điều kiện, tỉ lệ V1 : V2 là A. 1 : 1 B. 2 : 1 C. 5 : 2 D. 3 : 1
Đọc tiếp
Cho hỗn hợp X gồm O2, O3 có tỉ khối so với H2 bằng 22. Cho hỗn hợp Y gồm metylamin và etylamin có tỉ khối so với H2 = 17,8333. Đốt hoàn toàn V2 lít Y cần V1 lít X. Các khí đo cùng điều kiện, tỉ lệ V1 : V2 là
A. 1 : 1
B. 2 : 1
C. 5 : 2
D. 3 : 1