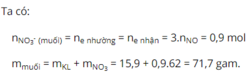hòa tan 19,2g Cu = dd HNO3 toàn bộ lượng khí NO sp khử duy nhất. tính n của NO

Những câu hỏi liên quan
Hòa tan hoàn toàn 15,9g hỗn hợp 3 kim loại Al, Mg, Cu bằng dd HNO 3 thu được 6,72 lit khí NO (là sản phẩm khử duy nhất ở đktc) và dd X. Đem cô cạn dd X thì thu được khối lượng muối khan là
A. 77,1g.
B. 71,7g.
C. 17,7g.
D. 53,1g.
Hòa tan hoàn toàn 3,84g Cu trong dd HNO3 dư, thu đc khí NO (sp khử duy nhất).Trộn NO trên với O2 dư, thu đc hh khí Y.Sục Y trong nc dư, thu đc dd Z và còn lại khí O2 duy nhất .Tổng thể tích O2 (đktc) đã pư là bao nhiêu ?
\(n_{Cu}=0,06mol\). Bỏa toàn e : \(2n_{Cu}=3n_{NO}\Rightarrow n_{NO}=0,04mol\)
Xét pư tổng :
\(2NO+1,5O_2+H_2O\rightarrow2HNO_3\)
\(\Rightarrow\)\(n_{O_2}=0,03mol\Rightarrow V_{O_2}=0,672l\)
Đúng 0
Bình luận (0)
\(n_{Cu}=\frac{2,84}{64}=0,06\left(l\right)\)
bảo toàn e : \(2n_{Cu}=3n_{NO}\)
=> \(n_{NO}=\frac{2}{3}n_{Cu}=0,04\left(mol\right)\)
\(2NO+1,5O_2+H_2O->2HNO_3\left(1\right)\)
theo (1) \(n_{O_2}=\frac{1,5}{2}n_{NO}=0,03\left(mol\right)\)
=> \(V_{O_2}=0,03.22,4=0,672\left(l\right)\)
Đúng 0
Bình luận (0)
Cho 19,2g Cu tan hoàn toàn trong dd HNO3 1M thì thu được V lít khí NO (đktc). Tính thể tích khí NO và thể tích dung dịch HNO3.
Ta có: \(n_{Cu}=\dfrac{19,2}{64}=0,3\left(mol\right)\)
Bảo toàn electron: \(2n_{Cu}=3n_{NO}\) \(\Rightarrow n_{NO}=\dfrac{2n_{Cu}}{3}=0,2\left(mol\right)\)
\(\Rightarrow V_{NO}=0,2\cdot22,4=4,48\left(l\right)\)
Mặt khác: \(n_{HNO_3}=n_{e\left(trao.đổi\right)}+n_{NO}=0,8\left(mol\right)\) \(\Rightarrow V_{HNO_3}=\dfrac{0,8}{1}=0,8\left(l\right)\)
Đúng 1
Bình luận (0)
Hỗn hợp X gồm 0,25 mol Cu2S và a mol FeS2. Hòa tan hết X trong dung dịch HNO3 ( vừa đủ ) thu được dd Y chỉ chứa 2 muối sunfat và thoát ra khí NO ( sp khử duy nhất ). Tính a
Hòa tan hoàn toàn 6,08g hỗn hợp bột Fe và Cu trong HNO3 0,8M vừa đủ . Thu được dung dịch X và 1,792 lít khí NO (đktc)(sản phẩm khử duy nhất) Tính % khối lượng mỗi kim loại trong hỗn hợp ban đâu
Gọi: \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_{Cu}=y\left(mol\right)\end{matrix}\right.\)
⇒ 56x + 64y = 6,08 (1)
Ta có: \(n_{NO}=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
Theo ĐLBT mol e, có: 3x + 2y = 0,08.3 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,04\left(mol\right)\\y=0,06\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,04.56}{6,08}.100\%\approx36,8\%\\\%m_{Cu}\approx63,2\%\end{matrix}\right.\)
Bạn tham khảo nhé!
Đúng 0
Bình luận (0)
Cho 19,2g Cu td vừa đủ với 400ml dd HNO3 thu được V lít dd NO ở đktc (sphẩm khử duy nhất).
a. Tính giá trị V?
b. Tính nồng độ mol dung dịch HNO3 đã dùng?
a, \(n_{Cu}=\dfrac{19,2}{64}=0,3\left(mol\right)\)
PTHH: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Mol: 0,3 0,8 0,2
\(V_{NO}=0,2.22,4=4,48\left(l\right)\)
b, \(C_{M_{ddHNO_3}}=\dfrac{0,8}{0,4}=2M\)
Đúng 1
Bình luận (1)
Câu 58. Cho 15,92 g hỗn hợp Ag và Cu phản ứng hoàn toàn với dd HNO3 loãng dư, thì có 3,36 lit khí NO (đktc) (sản phẩm khử duy nhất) bay ra. % khối lượng Ag trong hỗn hợp ban đầu là bn?
Câu 59. Hòa tan hoàn toàn 3,23 gam hh A (Zn và Cu) bằng 100 ml dd HNO3 thì thu được 2,24 lít khí màu nâu đỏ bay ra.
a. Viết các pt phản ứng .
b. Tính thành phần trăm theo khối lương các kim loại trong hh A.
c. Xác nồng độ mol HNO3 cần dùng và khối lượng muối tạo thành.
Đọc tiếp
Câu 58. Cho 15,92 g hỗn hợp Ag và Cu phản ứng hoàn toàn với dd HNO3 loãng dư, thì có 3,36 lit khí NO (đktc) (sản phẩm khử duy nhất) bay ra. % khối lượng Ag trong hỗn hợp ban đầu là bn? Câu 59. Hòa tan hoàn toàn 3,23 gam hh A (Zn và Cu) bằng 100 ml dd HNO3 thì thu được 2,24 lít khí màu nâu đỏ bay ra. a. Viết các pt phản ứng . b. Tính thành phần trăm theo khối lương các kim loại trong hh A. c. Xác nồng độ mol HNO3 cần dùng và khối lượng muối tạo thành.
Câu 58 :
Gọi $n_{Ag} = a(mol) ; n_{Cu} = b(mol) \Rightarrow 108a + 64b = 15,92(1)$
$n_{NO} = 0,15(mol)$
Bảo toàn electron :$a + 2b =0,15.3 = 0,45(2)$
Từ (1)(2) suy ra a = 0,02 ; b = 0,215
$\%m_{Ag} = \dfrac{0,02.108}{15,92}.100\% = 13,57\%$
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn 7,68 gam Cu bằng dung dịch H N O 3 loãng (dư), sinh ra V lít khí NO (sản phẩm khử duy nhất, đo ở đktc). Giá trị của V là
A. 0,896
B. 2,688
C. 5,376
D. 1,792.
Đáp án D
Bảo toàn electron có: 2. n C u = 3 . n N O → n N O = 0,08 mol
→ V N O = 0,08.22,4 = 1,792 lít.
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 7,68 gam Cu bằng dung dịch H N O 3 loãng (dư), sinh ra V lít khí NO (sản phẩm khử duy nhất, đo ở đktc). Giá trị của V là
A. 0,896.
B. 2,688.
C. 5,376.
D. 1,792.