Cho 6,72 lít hỗn hợp gồm metan, etilen và axetilen (đkc) được dẫn qua dung dịch AgNO3/NH3 dư thấy có 12 gam kết tủa vàng nhạt. Hỗn hợp khí còn lại dẫn tiếp tục qua nước brom, thấy khối lượng bình này tăng thêm 4,2 gam. Xác định %V các khí trong hỗn hợp ban đầu.

Những câu hỏi liên quan
Dẫn 6,72 lit hỗn hợp khí X gồm propan, etilen và axetilen đi qua dung dịch brom dư, thấy còn 1,68 lít khí không hấp thụ. Nếu dẫn 6,72 lit hỗn hợp khí X trên qua dung dịch AgNO3/NH3 thấy có 24,24 gam kết tủa. Các thể tích khí đo ở đktc. Tính thành phần phần trăm theo thể tích và theo khối lượng của mỗi khí trong hỗn hợp.
1,68 lit khí không bị dung dịch Br2 hấp thụ là propan
![]()
![]()
![]()
![]()
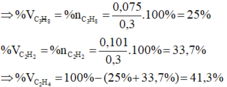
![]()
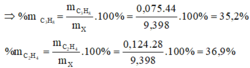
![]()
Đúng 1
Bình luận (0)
Dẫn 6,72 lít (đkc) hỗn hợp metan, etilen, axetilen vào dung dịch AgNO3/NH3 dư thấy sinh ra m gam kết tủa vàng và còn 4,48 lít (đkc) hỗn hợp khí X, hấp thụ X vào dung dịch Brom dư thấy dung dịch bị nhạt màu và bay ra 1,12 lít(đkc) khí Y.
a/ Viết các PTPƯ xảy ra, tính phần trăm thể tích mỗi khí trong hỗn hợp đầu.
b/ Tính khối lượng kết tủa vàng thu được
Hỗn hợp khí A gồm etan, etilen và axetilen. Dẫn 13,44 lít hỗn A qua lượng dư dung dịch brom thì có 6,72 lít khí thoát ra. Còn nếu cho cùng lượng hỗn hợp A trên qua lượng dư dung dịch AgNO3 trong NH3 thì thu được 24 gam kết tủa. Biết các thể tích khí được đo ở đktc. Hãy tính thành phần % theo khối lượng của mỗi chất có trong hỗn hợp khí A.
\(V_{C_2H_6}=13,44-6,72=6,72\left(l\right)\)
=> \(n_{C_2H_6}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(n_{C_2Ag_2}=\dfrac{24}{240}=0,1\left(mol\right)\)
=> \(n_{C_2H_2}=0,1\left(mol\right)\)
=> \(n_{C_2H_4}=\dfrac{13,44}{22,4}-0,3-0,1=0,2\left(mol\right)\)
=> \(\left\{{}\begin{matrix}\%m_{C_2H_6}=\dfrac{0,3.30}{0,3.30+0,2.28+0,1.26}.100\%=52,326\%\\\%m_{C_2H_4}=\dfrac{0,2.28}{0,3.30+0,2.28+0,1.26}.100\%=32,558\%\\\%m_{C_2H_2}=\dfrac{0,1.26}{0,3.30+0,2.28+0,1.26}.100\%=15,116\%\end{matrix}\right.\)
Đúng 4
Bình luận (0)
Dẫn 6,72 lit hỗn hợp khí X gồm propan, etilen và axetilen đi qua dung dịch brom dư, thấy còn 1,68 lít khí không hấp thụ. Nếu dẫn 6,72 lit hỗn hợp khí X trên qua dung dịch AgNO3/NH3 thấy có 24,24 gam kết tủa. Các thể tích khí đo ở đktc.
Viết các phương trình hoá học giải thích các thí nghiệm trên.
CH2=CH2 + Br2 → CH2Br-CH2Br
CH≡CH + Br2 → CHBr2-CHBr2
CH≡CH + 2AgNO3 + 2NH3 → AgC≡CAg↓vàng + 2NH4NO3
Khí không bị hấp thụ (hay không có phản ứng) là khí propan (C3H8)
Đúng 0
Bình luận (0)
Dẫn 5, 6 lít khí đktc gồm metan etilen axetilen qua dung dịch agno3/nh3 thì thu được 24g kết tủa cũng lượng hỗn hợp trên nên cho qua dung dịch brom thì thấy có 48g br2 phản ứng . Tìm%m mỗi chất trong hỗn hợp đầu
Xem chi tiết
nhh = 5.6/22.4 = 0.25(mol)
nAg2C2 = nC2H2 = 24/240 = 0.1 (mol)
nBr2 = 0.3 (mol)
=> nC2H4 = 0.3 - 0.1*2 = 0.1 (mol)
nCH4 = 0.25 - 0.1 - 0.1 = 0.05 (mol)
mCH4 = 0.05*16 = 0.8 (g)
mC2H2 = 0.1*26 = 2.6 (g)
mC2H4 = 0.1*28 = 2.8 (g)
mhh = 0.8 + 2.6 + 2.8 = 6.2 (g)
%CH4 = 0.8/6.2 * 100% = 12.9%
%C2H4 = 2.8/ 6.2 * 100% = 45.16%
%C2H2 = 41.94%
Đúng 2
Bình luận (0)
Dẫn hỗn hợp khí X gồm etilen và axetilen qua bình đựng dung dịch AgNO3 trong NH3 dư đến khi phản ứng xảy ra hoàn toàn thu được 28,8 gam kết tủa và thấy có 2,912 lít khí (đo ở đktc) thoát ra.Phần trăm khối lượng của axetilen trong X là A. 50,15% B. 53,85% C. 46,15% D. 49,85%
Đọc tiếp
Dẫn hỗn hợp khí X gồm etilen và axetilen qua bình đựng dung dịch AgNO3 trong NH3 dư đến khi phản ứng xảy ra hoàn toàn thu được 28,8 gam kết tủa và thấy có 2,912 lít khí (đo ở đktc) thoát ra.Phần trăm khối lượng của axetilen trong X là
A. 50,15%
B. 53,85%
C. 46,15%
D. 49,85%
Đáp án C
C2H2 và C2H4 cho qua dd AgNO3 chỉ có C2H2 phản ứng => khí đi ra là khí C2H4
BTNT C: nC2H2 = nAg2C2 = 28,8: 240 = 0,12 (mol)
nC2H4 = 2,912 : 22,4 = 0,13 (mol)
%m C2H2 = (mC2H2 : mhh khí).100% = [ 0,12. 26 : (0,12.26 + 0,13.28)].100% = 46,15%
Đúng 0
Bình luận (0)
Dẫn hỗn hợp khí X gồm etilen và axetilen qua bình đựng dung dịch AgNO3 trong NH3 (dư) đến khi phản ứng xảy ra hoàn toàn thì thu được 28,8 gam kết tủa và thấy có 2,912 lít khí (đo ở đktc) thoát ra. Phần trăm khối lượng của axetilen trong X là A. 53,85%. B. 46,15%. C. 50,15%. D. 49,85%..
Đọc tiếp
Dẫn hỗn hợp khí X gồm etilen và axetilen qua bình đựng dung dịch AgNO3 trong NH3 (dư) đến khi phản ứng xảy ra hoàn toàn thì thu được 28,8 gam kết tủa và thấy có 2,912 lít khí (đo ở đktc) thoát ra. Phần trăm khối lượng của axetilen trong X là
A. 53,85%.
B. 46,15%.
C. 50,15%.
D. 49,85%..
ĐÁP ÁN B
Chỉ có C2H2 phản ứng tạo Ag2C2 => nkhí = nC2H4 = 0,13 mol
,nAg2C2 = nC2H2 = 0,12 mol
=> %mC2H2 = 46,15%
Đúng 0
Bình luận (0)
Hỗn hợp X gồm etilen,propan,propin. dẫn 3,584 lít khí x(đktc) lần lượt qua 2 bình: bình 1 đựng dung dịch agno3/nh3 dư; bình 2 đựng 80 ml dung dịch Br2 1M. Thấy ở bình 1 có 5,88 gam kết tủa; dung dịch ở bình 2 bị nhạt bớt màu vàng và có 1,792 lít khí(đktc) thoát ra.a) Tính % thể tích mỗi khí trong hỗn hợp Xb) Nếu dẫn 1,792 lít hỗn hợp X ở trên vào 80 ml dung dịch Br2 1M thì hiện tượng phản ứng sẽ như thế nào? Vì sao?Giusp em câu này với ạ! Em cảm ơn nhiều
Đọc tiếp
Hỗn hợp X gồm etilen,propan,propin. dẫn 3,584 lít khí x(đktc) lần lượt qua 2 bình: bình 1 đựng dung dịch agno3/nh3 dư; bình 2 đựng 80 ml dung dịch Br2 1M. Thấy ở bình 1 có 5,88 gam kết tủa; dung dịch ở bình 2 bị nhạt bớt màu vàng và có 1,792 lít khí(đktc) thoát ra.
a) Tính % thể tích mỗi khí trong hỗn hợp X
b) Nếu dẫn 1,792 lít hỗn hợp X ở trên vào 80 ml dung dịch Br2 1M thì hiện tượng phản ứng sẽ như thế nào? Vì sao?
Giusp em câu này với ạ! Em cảm ơn nhiều
Ta có: \(n_X=\dfrac{3,584}{22,4}=0,16\left(mol\right)\)
- Cho hh khí quá bình 1:
PT: \(C_3H_4+AgNO_3+NH_3\rightarrow AgC_3H_3+NH_4NO_3\)
Ta có: \(n_{AgC_3H_3}=\dfrac{5,88}{147}=0,04\left(mol\right)\)
Theo PT: \(n_{C_3H_4}=n_{AgC_3H_3}=0,04\left(mol\right)\)
- Cho tiếp hh khí còn lại qua bình 2, thấy dd Br2 nhạt màu.
→ Br2 dư, C2H4 pư hết. Khí thoát ra là C3H8.
PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Ta có: \(n_{C_3H_8}=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
a, \(\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,16-0,08-0,04}{0,16}.100\%=25\%\\\%V_{C_3H_4}=\dfrac{0,04}{0,16}.100\%=25\%\\\%V_{C_3H_8}=50\%\end{matrix}\right.\)
b, Ta có: \(n_X=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
\(\Rightarrow X\left\{{}\begin{matrix}n_{C_2H_4}=0,08.25\%=0,02\left(mol\right)\\n_{C_3H_4}=0,08.25\%=0,02\left(mol\right)\\n_{C_3H_8}=0,04\left(mol\right)\end{matrix}\right.\) \(\Rightarrow n_{\pi}=n_{C_2H_4}+2n_{C_3H_4}=0,06\left(mol\right)\)
\(n_{Br_2}=0,08.1=0,08\left(mol\right)\)
⇒ nπ < nBr2
→ Br2 dư. Hiện tượng: Dd Br2 nhạt màu dần.
Đúng 2
Bình luận (0)
Dẫn 10,08 lít (ĐKTC) hỗn hợp X gồm metan, etilen và propin qua dung dịch AgNO3/NH3 dư thu được 29,4g kết tủa. Nếu dẫn X qua dd brom dư thì khối lượng bình brom tăng 12,2g. Xác định thành phần phần trăm về thể tích của hỗn hợp X
Xem chi tiết
Khi dẫn X qua AgNO3/NH3 thì chỉ có propin phản ứng
CHΞC-CH3 + AgNO3 + NH3 → AgCΞC-CH3 ↓ + NH4NO3
nAgCΞC-CH3 = \(\dfrac{29,4}{147}\)= 0,2 mol = nPropin
Nếu dẫn X qua bình đựng dd brom dư thì khối lượng bình tăng = mPropin + m Etilen
<=> 12,2 = mPropin + m Etilen
<=> 0,2.40 + mEtilen = 12,2
<=> mEtilen = 4,2 gam => nEtilen = 4.2:28 = 0,15 mol
nX = 10,08 : 22,4 = 0,45 mol
=> %V Etilen = \(\dfrac{0,15}{0,45}\).100% = 33,33%
%V Propin = \(\dfrac{0,2}{0,45}\).100% = 44,44%
=> %V Metan = 100 - 33,33 - 44,44 = 22,23%
Đúng 1
Bình luận (0)
















