A là dung dịch H2 SO4 0,2M, B là dung dịch H2 SO4 0,5M. Phải trộn A và B theo tỉ lệ thể tích như thế nào để được dung dịch H2 SO4 0,3M

Những câu hỏi liên quan
Dung dịch H2 SO4 có nồng độ 0,2M (dung dịch A) dung dịch H2 SO4 có nồng độ 0,5M (dung dịch B).a) nếu Trộn A và B theo tỉ lệ thể tích Va: Vb = 2 : 3 được dung dịch C Hãy xác định nồng độ mol của dung dịchC. b) Phải trộn A và B theo tỉ lệ nào về thể tích để được dung dịch H2SO4 có nồng độ 0,3M.
Giải hộ E...^_^
a)
Coi V A = 2(lít) => V B = 3(lít)
Trong dung dịch C, ta có :
V C = V A + V B = 2 + 3 = 5(lít)
n H2SO4 = n H2SO4(trong A) + n H2SO4(trong B) = 2.0,2 + 3.0,5 = 1,9(mol)
Suy ra :
CM H2SO4 = 1,9/5 = 0,38M
b)
Sau khi trộn :
V C = V A + V B
n H2SO4 = 0,2V A + 0,5V B
Suy ra :
CM H2SO4 = (0,2V A + 0,5V B)/(V A + V B ) = 0,3
<=> 0,2V A + 0,5V B = 0,3V A + 0,3V B
<=> 0,1V A = 0,2V B
<=> V A / V B = 0,2/0,1 = 2 / 1
Vậy phải trộn A và B theo tỉ lệ 2 : 1 về thể tích
Đúng 3
Bình luận (0)
\(GS:\)
\(V_A=2\left(l\right),V_B=3\left(l\right)\)
\(n_{H_2SO_4\left(1\right)}=0.2\cdot2=0.4\left(mol\right)\)
\(n_{H_2SO_4\left(2\right)}=0.5\cdot3=1.5\left(mol\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{0.4+1.5}{2+3}=0.38\left(M\right)\)
\(b.\)
\(V_{H_2SO_4\left(1\right)}=a\left(l\right)\)
\(V_{H_2SO_4\left(2\right)}=b\left(l\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{0.2a+0.5b}{a+b}=0.3\left(M\right)\)
\(\Leftrightarrow0.2a+0.5b-0.3a-0.3b=0\)
\(\Leftrightarrow0.2b=0.1a\)
\(\Leftrightarrow\dfrac{a}{b}=\dfrac{0.2}{0.1}=2\)
Đúng 1
Bình luận (0)
Câu 5 (2,0 điểm): A là dung dịch H2SO4 0,2M, B là dung dịch H2SO4 0,5M. Phải trộn A và B theo tỉ lệ thể tích như thế nào để được dung dịch H2SO4 0,3M
Đặt a,b lần lượt là thể tích của ddA và ddB
\(\Rightarrow0,2a+0,5b=0,3.\left(a+b\right)\\ \Leftrightarrow0,3a-0,2a=0,5b-0,3b\\ \Leftrightarrow0,1a=0,2b\\ \Leftrightarrow\dfrac{a}{b}=\dfrac{0,2}{0,1}=\dfrac{2}{1}\)
=> Trộn theo tỉ lệ thể tích ddA:ddB=2:1
Đúng 1
Bình luận (0)
X là dung dịch H2 SO4 y là dung dịch NaOH Nếu trộn x và y theo tỉ lệ thể tích Vx:Vy= 3:2 thu được dung chứa x dư Trung Hòa 1 lít A cần 40 gam KOH 28% Nếu trộn x y theo tỉ lệ thể tích Vx:Vy=2:3 thì thu được dung dịch b chứa y dư Trung Hòa 1 lít b cần 29,2 gam dung dịch HCl 25% tính nồng độ mol của x và y
A là dung dịch
H
2
S
O
4
có nồng độ 0,2M. B là dung dịch
H
2
S
O
4
có nồng độ 0,5M.Phải trộn A và B theo tỉ lệ nào về thể tích để được dung dịch
H
2
S
O
4
có nồng độ 0,3M.
Đọc tiếp
A là dung dịch H 2 S O 4 có nồng độ 0,2M. B là dung dịch H 2 S O 4 có nồng độ 0,5M.
Phải trộn A và B theo tỉ lệ nào về thể tích để được dung dịch H 2 S O 4 có nồng độ 0,3M.
Pha chế dung dịch H 2 S O 4 0,3M.
Gọi x(l) là thể tích của dung dịch axit A.
y(l) là thể tích của dung dịch B.
n H 2 S O 4 ( A ) = C M . V A = 0,2 . x (mol)
n H 2 S O 4 ( B ) = C M . V B = 0,5 . y (mol)
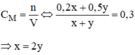
Vậy: ta phải trộn 2 thể tích dung dịch axit A với 1 thể tích dung dịch axit B, ta sẽ được dung dịch H 2 S O 4 có C M = 0,3M.
Đúng 1
Bình luận (0)
Dung dịch A gồm HCl 0,2M ; HNO3 0,3M; H2SO4 0,1M; HClO4 0,3M, dung dịch B gồm KOH 0,3M; NaOH 0,4M, Ba(OH)2 0,15M. Cần trộn A và B theo tỉ lệ thể tích là bao nhiêu để được dung dịch có pH13? A. 11:9 B. 9:11 C. 101:99 D. 99:101
Đọc tiếp
Dung dịch A gồm HCl 0,2M ; HNO3 0,3M; H2SO4 0,1M; HClO4 0,3M, dung dịch B gồm KOH 0,3M; NaOH 0,4M, Ba(OH)2 0,15M. Cần trộn A và B theo tỉ lệ thể tích là bao nhiêu để được dung dịch có pH=13?
A. 11:9
B. 9:11
C. 101:99
D. 99:101
Đáp án A
Gọi thể tích dung dịch A là V1 lít. Có nH+ = ( 0,2+0,3+0,1.2+0,3).V1 = V1 mol
Gọi thể tích dung dịch B là V2 lít. Có nOH- = ( 0,3+ 0,4+ 0,15.2).V2 = V2 mol
H+ + OH- → H2O
V1 V2
Dung dịch thu được có pH = 13 nên OH- dư
nOHdư = V2- V1 mol
[OH-]dư = (V2-V1)/(V2+ V1) = 10-1 suy ra V1: V2 = 11:9
Đúng 0
Bình luận (0)
Dung dịch A gồm HCl 0,2M; HNO3 0,3M; H2SO4 0,1M; HClO4 0,3M, dung dịch B gồm KOH 0,3M; NaOH 0,4M; Ba(OH)2 0,15M. Cần trộn A và B theo tỉ lệ thể tích là bao nhiêu để được dung dịch có pH 13? A. 11 : 9. B. 9 : 11. C. 101 : 99. D. 99 : 101.
Đọc tiếp
Dung dịch A gồm HCl 0,2M; HNO3 0,3M; H2SO4 0,1M; HClO4 0,3M, dung dịch B gồm KOH 0,3M; NaOH 0,4M; Ba(OH)2 0,15M. Cần trộn A và B theo tỉ lệ thể tích là bao nhiêu để được dung dịch có pH = 13?
A. 11 : 9.
B. 9 : 11.
C. 101 : 99.
D. 99 : 101.
Chọn B.
Nồng độ H+ ban đầu là: (0,2 + 0,3 + 0,1.2 + 0,3) = 1M.
Nồng độ OH- ban đầu là: (0,3 + 0,4 + 0,15.2) = 1M.
Dung dịch sau phản ứng có pH = 13, suy ra OH- dư, pOH = 1.
Nồng độ OH- dư là: 10-1 = 0,1M.
Áp dụng sơ đồ đường chéo cho trường hợp OH- dư, ta được:
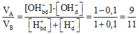
Đúng 0
Bình luận (0)
Dung dịch A gồm HCl 0,2M; HNO3 0,3M; H2SO4 0,1M; HClO4 0,3M, dung dịch B gồm KOH 0,3M; NaOH 0,4M; Ba(OH)2 0,15M. Cần trộn A và B theo tỉ lệ thể tích là bao nhiêu để được dung dịch có pH 13? A. 11 : 9 B. 9 : 11 C. 101 : 99 D. 99 : 101
Đọc tiếp
Dung dịch A gồm HCl 0,2M; HNO3 0,3M; H2SO4 0,1M; HClO4 0,3M, dung dịch B gồm KOH 0,3M; NaOH 0,4M; Ba(OH)2 0,15M. Cần trộn A và B theo tỉ lệ thể tích là bao nhiêu để được dung dịch có pH = 13?
A. 11 : 9
B. 9 : 11
C. 101 : 99
D. 99 : 101
Đáp án B.
Nồng độ H+ ban đầu là: (0,2 + 0,3 + 0,1.2 + 0,3) = 1M.
Nồng độ OH- ban đầu là: (0,3 + 0,4 + 0,15.2) = 1M.
Dung dịch sau phản ứng có pH = 13, suy ra OH- dư, pOH = 1.
Nồng độ OH- dư là: 10-1 = 0,1M.
Áp dụng sơ đồ đường chéo cho trường hợp OH- dư, ta được:
VA/VB = (1-0,1)/(1+0,1) = 9/11
Đúng 0
Bình luận (0)
A là dung dịch H2SO4 0,2M, B là dung dịch H2SO4 0,5M. Trộn A và B theo tỉ lệ thể tích VA : VB = 2:3 được dung dich C.
a) Xác đinh Nồng độ mol của C
b) Phải trộn A và B theo tỉ lệ thể tích như thế nào để được dung dịch H2SO4 0,3M
a/ Theo quy tắc đường chéo ta có:
\(\dfrac{2}{3}=\dfrac{0,5-C_{MC}}{C_{MC}-0,2}\)
\(\Leftrightarrow C_{MC}=0,38\left(M\right)\)
b/ Theo quy tắc đường chéo ta có:
\(\dfrac{V_A}{V_B}=\dfrac{0,5-0,3}{0,3-0,2}=2\)
Đúng 0
Bình luận (3)
Hòa tan 18,6 gam hỗn hợp gồm Fe và Al2 O3 bằng một lượng dung dịch H2 SO4 loãng 3 m vừa đủ thu được 3,6 l khí ở điều kiện tiêu chuẩn và dung dịch a a Tính phần trăm khối lượng mỗi chất có trong hỗn hợp ban đầu b Tính thể tích dung dịch axit H2 SO4 đã dùng
















