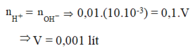Tính V ml dd KOH 0,1M cần dùng để trung hòa 10ml dd X gồm 2 axit HCl và HNO3 có pH=2

Những câu hỏi liên quan
Tính V ml dd KOH 0,1M cần dùng để trung hòa 10ml dd X gồm 2 axit HCl và HNO3 có pH = 2 ?
Ta có :
pH= 2
=> [H+]= 0.01
=> nH+= \(10^{-4}\) mol
Để trung hòa vừa đủ dd axit cần :
nOH-= \(10^{-4}\) mol
<=> 0.1V = \(10^{-4}\)
=> V = 0.001 lít = 1 ml
Đúng 0
Bình luận (0)
Trộn các dd axit HCl 0,3M; h2SO4 0,1M với những thể tích bằng nhau đc dd X. Dùng 300ml dd X trung hòa V ml dd B có NaOH 0,2M và KOH 0,15M thu đc dd Y.
1. Tính V
2. Cô cạn dd Y thu đc bao nhiêu gam muối khan
+nHCl=0.2*0.4=0.08(mol)
=>nH{+}=0.08(mol)
+nHNO3=0.1*0.4=0.04(mol)
=>nH{+}=0.04(mol)
+nH2SO4=0.15*0.4=0.06(mol)=nSO4{2-}
=>nH{+}=0.06*2=0.12(mol)
=>nH{+}(tổng)=0.08+0.04+0.12=0.24(mol)
+nNaOH=0.2*10^-3V(mol)
=>nOH{-}=2*10^-4V(mol)
+nBa(OH)2=0.05*10^-3V(mol)=nBa{2+}
=>nOH{-}=2*5*10^-5V=10^-4V(mol)
=>nOH{-}(tổng)=2*10^-4V+10^-4V=3*10^-4...
_Sau phản ứng thu được dung dịch có pH=13=>môi trường có tính bazơ.
=>pOH=14-13=1=>[OH-] dư=10^-1(M)
=>nOH{-} dư=10^-1*(0.4+10^-3V)(mol)
H{+}+OH{-}=>H2O
0.24->3*10^-4V...(mol)
0.24->0.24...........(mol)
0------>3*10^-4V-0.24.(mol)
=>3*10^-4V-0.24=0.04+10^-4V
<=>2*10^-4V=0.28
<=>V=1400(ml)
Vậy cần V=1400 ml
_Sau phản ứng kết tủa tạo thành là BaSO4:
+nBa{2+}=5*10^-5*(1400)=0.07(mol)
+nSO4{2-}=0.06(mol)
Ba{2+}+SO4{2-}=>BaSO4
0.07>0.06----------->0.06(mol)
=>mBaSO4=0.06*233=13.98(g)
Đúng 0
Bình luận (0)
Cho 100ml dd chứa Ba(OH)2 0,1M và KOH 0,2M vào 100ml dd chứa hcl 0,2M và HNO3 0,2M được dd Z. a) Tính pH của dung dịch Z b) tính nồng độ mol của 400ml dd nạo dùng để trung hòa hết dd Z
bài 1: cần bao nhiêu ml dd KOH 1,5M để dung hòa 300ml dd A gồm H2SO4 0,75M, HCL 1,5M.
bài 2: dd A chứa HCL và H2SO4 theo tỷ lệ mol 3/1 biết rằng 100ml dd A trung hòa bởi 50ml dd NAOH có chứa 20g NAOH trên 1 lít .
a, tính Cm của mỗi axit
b, 200ml dd A phản ứng vừa đủ với bao nhiêu ml dd B gồm NAOH 0,2M và Ba(OH)2 0,1M.
mn giải gấp giúp e vs ạ...c.ơn
1. Ptrình ion H(+) + OH(-) = H2O
n H(+) 0,3*0,75*2 + 0,3*1,5 = 0,9mol
=> n OH(-) = 0,9mol => n KOH = 0,9mol => V = 0,6l
2. a) nNaOH= 0,05.20/40=0,025 mol
NaOH + HCl ------> NaCl +H2O
....3x.........3x
2NaOH +H2SO4------> Na2SO4 + 2H2O
.....2x.........x
tỉ lệ mol 2 axit HCl : H2SO4 =3:1
đặt số mol H2SO4 la` x ----> nHCl =3x
>>>>3x+2x =0,025 >>>x=0,05 mol
=>nồng độ mol của HCl va` H2SO4 lần lươt la` 1,5M & 0,5M
b) n(OH-) = nNaOH + 2nBa(OH)2 = 0,2V + 2.0,1.V=0,4V
trong 0,2l ddA có 0,3 mol HCl & 0,1 mol H2SO4 ( vi` V gấp đôi >> n gấp đôi)
=> n(H+)= nHCl + 2nH2SO4 = 0,5mol
ma` n(OH-) =n(H+)
=> 0,4V=0,5 >>V= 1,25l=1250ml
c) nNaOH=0,2.1,25=0,25mol = nBa(OH)2
nH2O = n(axit)= 0,3 +0,1 =0,4 mol
theo BTKL : m(muối) = m(axit) + m(bazo) -m(H2O)
..............................= 0,3.36,5 +0,1.98 + 0,25( 40+171) -0,4.18=66,3g
Đúng 0
Bình luận (0)
Bài 1: Trộn X là dd H2SO4 0.02M với Y là dd NaOH 0.035M thu được dd Z có pH=2. Tính tỉ lệ về thể tích giữa dd X và dd Y? ( Coi H2SO4 điện li hoàn toàn cả hai nấc)
Bài 2: Tính V ml dd KOH 0.1M cần dùng để trung hòa 10ml dd X gồm 2 axit HCl và HNO3 có pH=2?
Bài 3: Tính V dd NaOH 1.8M cần cho vào 0.5l dd H2SO4 1M để thu được dd có pH=13. ( Coi H2SO4 điện li hoàn toàn cả 2 nấc).
bài 1: Gọi V1 là thể tích dd axit . V2 là thể tích dd bazo
=> nH+ = 0,02.V1.2 = 0,04V1
nOH- = 0,035.V2
Pư: H+ + OH- ---> H2O
0,035V2 <------------ 0,035V2
=> [H+] sau pứ = (0,04V1 - 0,035V2) : (V1+V2) = 10-2
=> V1 : V2 = 3 : 2
Đúng 0
Bình luận (0)
bài 3: nOH- = 1,8V. nH+ = 0,5.2.1 = 1 mol
=> Vì dd sau pứ có pH =13 => OH- dư.
Ta có (1,8V - 1): (V + 0,5) = 10-(14 - 13) => V = ...
Đúng 0
Bình luận (0)
Cho dung dịch X có pH = 2 chứa HCl và HNO3. Thể tích dung dịch KOH 0,1M cần để trung hòa 10 ml dung dịch X là:
A. 0,5 ml.
B. 1 ml.
C. 1,5 ml.
D. 2 ml.
Cho dung dịch X có pH = 2 chứa HCl và HNO3. Thể tích dung dịch KOH 0,1M cần để trung hòa 10 ml dung dịch X là:
A. 0,5 ml
B. 1 ml.
C. 1,5 ml
D. 2 ml
Có 16 ml dd HCl nồng độ x M (dd A) . thêm nước vào dd A cho đến khi thu được dd có thể tích 200ml .lúc này cm của dd mới là 0,1M .tính x ? Lấy 10 ml A trung hòa hết dd KOH 0,5M .Tính v và cm của dd sau phản ứng. Cần gấp ạ
Cần bao nhiêu ml dd X ( gồm HCl và CH3COOH )để trung hòa 25 ml dd hỗn hợp Ba(OH)2 0,02M và NaOH 0,05M. Biết Cm HCl = 0,1M, Cm CH3COOH = 0,2M
Ta có: \(n_{Ba\left(OH\right)_2}=0,025.0,02=0,0005\left(mol\right)\)
\(n_{NaOH}=0,025.0,05=0,00125\left(mol\right)\)
\(\Rightarrow n_{OH^-}=2n_{Ba\left(OH\right)_2}+n_{NaOH}=0,00225\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(\Rightarrow n_{H^+}=n_{OH^-}=0,00225\left(mol\right)\)
Gọi: VX = x (l)
Ta có: \(n_{HCl}=0,1x\left(mol\right)\)
\(n_{CH_3COOH}=0,2x\left(mol\right)\)
\(\Rightarrow n_{H^+}=n_{HCl}+n_{CH_3COOH}=0,1x+0,2x=0,00225\)
\(\Rightarrow x=0,0075\left(l\right)=7,5\left(ml\right)\)
Đúng 3
Bình luận (0)