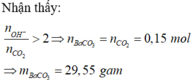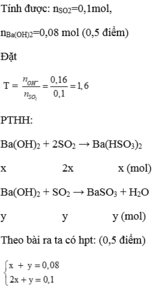Sục từ từ 2,24 lit CO2(đktc) vào 200ml dung dịch CA(OH)2 1M, kết thúc phản ứng thu được m gam kết tủa, tìm m?

Những câu hỏi liên quan
6/ A/ Cho hoàn toàn V lít khí CO2 (ở đktc) từ từ đi qua 200 ml dung dịch Ca(OH)2 2M. Sau khi phản ứng kết thúc thu được 20 gam chất kết tủa. Tìm giá trị của V?
B/ Sục x(lit) CO2 (đktc) vào 400ml dung dịch Ba(OH)2 0,5M thì thu được 4,925g kết tủa. Tính x.
C/ Dẫn 4,48 lít khí SO2 (đktc) vào một bình chứa 120g dung dịch NaOH 12,5%. Tính nồng độ % của dung dịch muối thu được? Các phản ứng xảy ra hoàn toàn.
Đọc tiếp
6/ A/ Cho hoàn toàn V lít khí CO2 (ở đktc) từ từ đi qua 200 ml dung dịch Ca(OH)2 2M. Sau khi phản ứng kết thúc thu được 20 gam chất kết tủa. Tìm giá trị của V? B/ Sục x(lit) CO2 (đktc) vào 400ml dung dịch Ba(OH)2 0,5M thì thu được 4,925g kết tủa. Tính x. C/ Dẫn 4,48 lít khí SO2 (đktc) vào một bình chứa 120g dung dịch NaOH 12,5%. Tính nồng độ % của dung dịch muối thu được? Các phản ứng xảy ra hoàn toàn.
a, Ta có : \(\left\{{}\begin{matrix}n_{CaCO3}=\dfrac{m}{M}=0,2\left(mol\right)\\n_{Ca\left(OH\right)2}=C_M.V=0,4\left(mol\right)\end{matrix}\right.\)
\(BTNT\left(Ca\right):n_{Ca\left(HCO_3\right)_2}=n_{Ca\left(OH\right)2}-n_{CaCO3}=0,2\left(mol\right)\)
\(BTNT\left(C\right):n_{CO2}=n_{CaCO3}+2n_{Ca\left(HCO3\right)2}=0,6\left(mol\right)\)
\(\Rightarrow V_{CO2}=13,44l\)
b, Ta có : \(\left\{{}\begin{matrix}n_{BaCO3}=\dfrac{m}{M}=0,025\left(mol\right)\\n_{Ba\left(OH\right)2}=C_M.V=0,2\left(mol\right)\end{matrix}\right.\)
\(BTNT\left(Ba\right):n_{Ba\left(HCO_3\right)_2}=n_{Ba\left(OH\right)2}-n_{BaCO3}=0,175\left(mol\right)\)
\(BTNT\left(C\right):n_{CO2}=n_{BaCO3}+2n_{Ba\left(HCO3\right)2}=0,375\left(mol\right)\)
\(\Rightarrow V_{CO2}=8,4l\)
c, Ta có : \(1< T=\dfrac{n_{NaOH}}{n_{SO2}}=1,875< 2\)
- Áp dụng phương pháp đường chéo :
Ta được : \(\dfrac{n_{NaHSO3}}{n_{Na2SO3}}=\dfrac{1}{7}\)
\(\Leftrightarrow7n_{NaHSO3}-n_{Na2SO3}=0\)
\(BTNT\left(Na\right):n_{NaHSO3}+2n_{Na2SO3}=0,375\)
\(\Rightarrow\left\{{}\begin{matrix}n_{NaHSO3}=0,025\\n_{Na2SO3}=0,175\end{matrix}\right.\)
\(\Rightarrow m_M=24,65g\)
Đúng 1
Bình luận (0)
Sục 5,6 lít khí CO2 (đktc) vào 200ml dung dịch hỗn hợp NaOH 1M, Ba(OH)2 0,5M, KOH 0,5M. Kết thúc phản ứng thu được m gam kết tủa. Trị số của m là:
A. 49,25 gam
B. 21,7 gam
C. 54,25 gam
D. 19,7 gam
Đáp án D
Ta có: nCO2= 5,6/22,4=0,25 mol
nBa(OH)2= 0,2. 0,5= 0,1 mol;
nNaOH= 0,2.1= 0,2 mol;
nKOH= 0,2.0,5= 0,1 mol
nOH-= 0,1.2 + 0,2 + 0,1= 0,5 mol; nBa2+= 0,1 mol
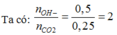
→ CO2 phản ứng với OH- theo PT sau:
CO2+ 2OH- → CO32-+ H2O (1)
0,25 0,5 0,25 mol
Ba2++ CO32- → BaCO3 (2)
Ta có 0,1 < 0,25 nên Ba2+ phản ứng hết
→ nBaCO3= nBa2+= 0,1 mol
→ mBaCO3= 0,1.197= 19,7 gam
Đúng 0
Bình luận (0)
Sục 0,15 mol khí CO2 vào 200ml dung dịch Ba(OH)2 1M, sau khi kết thúc phản ứng, thu được m gam kết tủa. Giá trị m là A. 29,55 gam B. 39,40 gam C. 23,64 gam D. 17,70 gam
Đọc tiếp
Sục 0,15 mol khí CO2 vào 200ml dung dịch Ba(OH)2 1M, sau khi kết thúc phản ứng, thu được m gam kết tủa. Giá trị m là
A. 29,55 gam
B. 39,40 gam
C. 23,64 gam
D. 17,70 gam
Dẫn từ từ 2,24 lít S O 2 (ở đktc) vào 80 ml dung dịch B a ( O H ) 2 1M. Kết thúc phản ứng thu được m gam kết tủa. Tính m?
Đem 22,4 lít khí CO2 (đktc) sục từ từ vào 5 lít dung dịch Ca(OH)2 0,15M. Kết thúc phản ứng thu được số gam kết tủa là: A. 75 gam B. 100 gam C. 50 gam D. 81 gam
Đọc tiếp
Đem 22,4 lít khí CO2 (đktc) sục từ từ vào 5 lít dung dịch Ca(OH)2 0,15M. Kết thúc phản ứng thu được số gam kết tủa là:
A. 75 gam
B. 100 gam
C. 50 gam
D. 81 gam
Đáp án C
nCO2 = 1 mol
nCa(OH)2 = 0,75 mol => nOH-= 1,5 mol
nkết tủa = nOH-- nCO2= 1,5-1 =0,5 mol
mCaCO3 = 0,5.100 = 50 gam
Đúng 0
Bình luận (0)
1. Hấp thụ hoàn toàn 2,24 lít CO2 vào 75ml dung dịch nước vôi trong Ca(OH)2 1M. Xác định lượng sản phẩm thu được sau phản ứng.
2. Sục 1,12 lít CO2(đktc) vào 200ml dung dịch Ba(OH)2 0,2M. Tính khối lượng kết tủa thu được.
3. Cho 2,24 lít CO2(đktc) tác dụng vừa đủ với 200ml dung dịch Ca(OH)2 sinh ra chất kết tủa trắng. Tính nồng độ mol/lít của dung dịch Ca(OH)2.
1.
\(n_{CO_2}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(n_{Ca\left(OH\right)_2}=0.075\left(mol\right)\)
\(T=\dfrac{0.1}{0.075}=1.33\)
=> Tạo ra 2 muối
\(n_{CaCO_3}=a\left(mol\right),n_{Ca\left(HCO_3\right)_2}=b\left(mol\right)\)
Khi đó :
\(a+b=0.075\)
\(a+2b=0.1\)
\(\Rightarrow\left\{{}\begin{matrix}a=0.05\\b=0.025\end{matrix}\right.\)
\(m_{sp}=0.05\cdot100+0.025\cdot162=9.05\left(g\right)\)
Đúng 2
Bình luận (0)
2.
\(n_{CO_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0.2\cdot0.2=0.04\left(mol\right)\)
\(T=\dfrac{0.005}{0.04}=1.25\)
=> Tạo ra 2 muối
\(n_{BaCO_3}=a\left(mol\right),n_{Ba\left(HCO_3\right)_2}=b\left(mol\right)\)
Ta có :
\(a+b=0.04\)
\(a+2b=0.05\)
\(\Rightarrow\left\{{}\begin{matrix}a=0.03\\b=0.01\end{matrix}\right.\)
\(m_{BaCO_3}=0.03\cdot197=5.91\left(g\right)\)
Đúng 2
Bình luận (0)
\(n_{CO_2}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
\(0.1...............0.1\)
\(C_{M_{Ca\left(OH\right)_2}}=\dfrac{0.1}{0.2}=0.5\left(M\right)\)
Đúng 2
Bình luận (0)
sục V lít co2 (đktc) vào 200ml dung dịch ca(oh)2 1M. Sau phản ứng thu được 10g kết tủa. Gía trị của V lít ?
nCa(OH)2= 0,2.1 = 0,2 mol.
nCaCO3 = 15 : 100 = 0,15mol
Cho NaOH vào dung dịch sau PƯ thấy xuất hiện kết tủa nên trong dd có muối Ca(HCO3)2
Vậy xảy ra 2 phản ứng:
CO2 + Ca(OH)2 -----> CaCO3 + H2O (1)
0,15 mol 0,15 mol 0,15 mol
2CO2 + Ca(OH)2 ------> Ca(HCO3)2 (2)
2. 0,05 mol 0,05 mol
Theo (1) : nCO2(1) = nCa(OH)2 (1) = nCaCO3 = 0,15mol
=> nCa(OH)2 (2) = 0,2 - 0,15 = 0,05 mol
Theo (2) : nCO2 (2) = 2. 0,05 = 0,1 mol
=> nCO2 = 0,15 + 0,1 = 0,25 mol
=> VCO2 = 0,25 . 22,4 = 5,6 (L)
Đúng 1
Bình luận (3)
Sục 0,15 mol khí CO2 vào 200 ml dung dịch Ba(OH)2 1M, sau khi kết thúc phản ứng, thu được m gam kết tủa. Giá trị m là A. 29,55. B. 39,40. C. 23,64. D. 19,70.
Đọc tiếp
Sục 0,15 mol khí CO2 vào 200 ml dung dịch Ba(OH)2 1M, sau khi kết thúc phản ứng, thu được m gam kết tủa. Giá trị m là
A. 29,55.
B. 39,40.
C. 23,64.
D. 19,70.
Sục 0,15 mol khí CO2 vào 200 ml dung dịch Ba(OH)2 1M, sau khi kết thúc phản ứng, thu được m gam kết tủa. Giá trị m là
A. 19,70 gam
B. 29,55 gam
C. 23,64 gam
D. 39,40 gam
Đáp án B.
Định hướng tư duy giải
m = 0,15.197 =29,55 gam
Đúng 0
Bình luận (0)