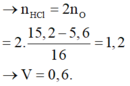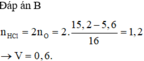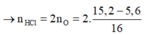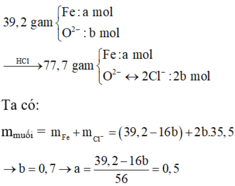Đốt cháy 5,6 gam Fe nung đỏ trong bình oxi thu được 7.36 gam hỗn hợp A gồm Fe2O3; Fe3O4; FeO và 1 phần Fe còn lại. Hòa tan hoàn toàn hỗn hợp A bằng V ml dung dịch HNO3 2M (đủ) thu được a lít khí NO2. Tính a và V

Những câu hỏi liên quan
Đôt cháy 5,6 g bột Fe nung đỏ trong bình oxi thu được 7,36g hỗn hợp A gồm Fe2O3, Fe3O4, FeO và một phần Fe còn lại, hòa tan hoàn toàn hỗn hợp A bằng dd HNO3 thu được v lit hh khí B ở đktc gồm NO2 và NO có tỉ khối so với H2 là 19, tính v
nFe = 0,1 mol. m O2 = 7,36 - 5,6 = 1,76 gam => n O2 = 0,055 mol
Đặt nNO = x, nNO2 = y
Ta có hệ: bảo toàn electron: 3.0,1 - 0,055.4 = 3x + y
30x + 44y / ( x+y) = 19.2
=> x= 0,02, y =0,02
=> V = 0,04.22,4 = 8,96 lít
Đúng 0
Bình luận (0)
Nung 5,6 gam Fe trong bình đựng oxi, sau phản ứng thu được 15,2 gam hỗn hợp T chỉ gồm toàn oxit. Hoà tan hoàn toàn T cần vừa đủ V lít dung dịch HCl 2M, giá trị của V là:
A. 0,3 lít
B. 0,6 lít
C. 0,9 lít
D. 1,2 lít
Nung 5,6 gam Fe trong bình đựng oxi, sau phản ứng thu được 15,2 gam hỗn hợp T chỉ gồm toàn oxit. Hoà tan hoàn toàn T cần vừa đủ V lít dung dịch HCl 2M, giá trị của V là:
A. 0,3 lít.
B. 0,6 lít.
C. 0,9 lít.
D. 1,2 lít.
Nung 5,6 gam Fe trong bình đựng oxi, sau phản ứng thu được 15,2 gam hỗn hợp T chỉ gồm toàn oxit. Hoà tan hoàn toàn T cần vừa đủ V lít dung dịch HCl 2M, giá trị của V là:
A. 0,3 lít.
B. 0,6 lít.
C. 0,9 lít.
D. 1,2 lít.
Đốt cháy m gam Fe trong oxi, sau phản ứng thu được hỗn hợp rắn chứa 0,012mol Fe;
0,12mol FeO; 0,01mol Fe3O4 và 0,01mol Fe2O3. Tính m.
Bảo toàn Fe: nFe(bđ) = 0,012 + 0,12 + 0,01.3 + 0,01.2 = 0,182 (mol)
=> m = 0,182.56 = 10,192 (g)
Đúng 0
Bình luận (0)
Một hỗn hợp gồm KMnO4 và KClO3 có khối lượng m gam đem nung nóng thu được chất rắn x và khí O2 trọng lượng khí oxi sinh ra với không khí theo tỉ lệ thể tích là 2/3 trong bình kín thu được hỗn hợp Y. Cho vào bình 1,128 gam cacbon rồi đốt cháy hết cacbon thu được hỗn hợp khí Z( có mặt một khí duy trì sự cháy) trong đó khí CO2 chiếm 27,5% về khối lượng. Tính khối lượng m ban đầu, biết trong chất rắn X có 43,5g MnO2 chiếm 46,4% về khối lượng
Đọc tiếp
Một hỗn hợp gồm KMnO4 và KClO3 có khối lượng m gam đem nung nóng thu được chất rắn x và khí O2 trọng lượng khí oxi sinh ra với không khí theo tỉ lệ thể tích là 2/3 trong bình kín thu được hỗn hợp Y. Cho vào bình 1,128 gam cacbon rồi đốt cháy hết cacbon thu được hỗn hợp khí Z( có mặt một khí duy trì sự cháy) trong đó khí CO2 chiếm 27,5% về khối lượng. Tính khối lượng m ban đầu, biết trong chất rắn X có 43,5g MnO2 chiếm 46,4% về khối lượng
Z gồm CO2 và O2 dư
$C + O_2 \xrightarrow{t^o} CO_2$
$n_{CO_2} =n_{O_2\ pư} = n_C = \dfrac{1,128}{12} = 0,094(mol)$
Gọi $n_{O_2} = 2a \to n_{không\ khí} = 3a(mol)$
Trong Y :
$n_{O_2} = 2a + 3a.20\% = 2,6a(mol)$
$n_{N_2} = 3a.80\% = 2,4a(mol)$
Trong Z :
$n_{CO_2} = 0,094(mol)$
$n_{N_2} = 2,4a(mol)$
$n_{O_2\ dư} = n_{O_2} - n_{O_2\ pư} = 2,6a - 0,094(mol)$
m CO2 =0,094.44 = 4,136(gam)
=> m Z = 4,136 : 27,5% = 15,04(gam)
SUy ra :
4,136 + 2,4a.28 + (2,6a - 0,094).32 = 15,04
=> a = 0,0925
=> n O2 = 0,0925.2 = 0,185(mol)
m X = 43,5 : 46,4% = 93,75(gam)
Bảo toàn khối lượng : m = 93,75 + 0,185.32 = 99,67(gam)
Đúng 2
Bình luận (1)
đốt cháy 5,6 gam bột fe trong bình đựng o2 thu được 7,36g hỗn hợp A gồm Fe, Fe2O3, Fe3O4,FeO. Hòa tan hoàn toàn A bằng H2SO4 đặc nóng thu được Fe2(SO4)3 và V(l) khí SO2(đktc). Tính V=?
Hòa tan hoàn toàn 18,8 gam hỗn hợp gồm Fe và FeS trong dung dịch HCl dư, thu được 5,6 lít hỗn hợp khí X (đktc). Đốt cháy hết hỗn hợp khí X rồi dẫn toàn bộ sản phẩm cháy vào dung dịch nước vôi trong dư thu được m gam kết tủa trắng. Giá trị của m là: A. 12. B. 18. C. 30. D. 15.
Đọc tiếp
Hòa tan hoàn toàn 18,8 gam hỗn hợp gồm Fe và FeS trong dung dịch HCl dư, thu được 5,6 lít hỗn hợp khí X (đktc). Đốt cháy hết hỗn hợp khí X rồi dẫn toàn bộ sản phẩm cháy vào dung dịch nước vôi trong dư thu được m gam kết tủa trắng. Giá trị của m là:
A. 12.
B. 18.
C. 30.
D. 15.
PTHH: Fe + 2HCl --> FeCl2 + H2
FeS + 2HCl --> FeCl2 + H2S
=> \(n_{Fe}+n_{FeS}=n_{H_2}+n_{H_2S}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Và 56.nFe + 88.nFeS = 18,8
=> \(\left\{{}\begin{matrix}n_{Fe}=0,1\left(mol\right)\\n_{FeS}=0,15\left(mol\right)\end{matrix}\right.\)
Bảo toàn S: nCaSO3 = 0,15 (mol)
=> m = 0,15.120 = 18 (g)
=> B
Đúng 3
Bình luận (0)
Đốt cháy a mol Fe trong khí oxi, thu được 39,2 gam hỗn hợp X chỉ gồm các oxit sắt. Hòa tan hoàn toàn X trong dung dịch HCl (vừa đủ), thu được 77,7 gam muôi. Giá trị của a là
A. 0,4.
B. 0,5.
C. 0,6.
D. 0,7.