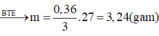Đem trộn các khí ; hidro ; metan và CO thành 2 lít hỗn hợp ở đktc và nặng 1,715 g .Để đốt cháy hết 4 lít hỗn hợp khí đó cần 19 lít không khí chứa 1/5 thể tích không khí.Hãy tính thành phần % thể tích của mỗi khí trong hỗn hợp

Những câu hỏi liên quan
Để chuẩn bị cho buổi thực hành thầy giáo đã lấy 5,46875g KClO3 đem trộn với một lượng nhỏ MnO2 rồi đem nung nóng
a) tính thể tích khí Oxi thu được biết hiệu xuất phản ứng là 80%
b) với lượng hóa chất như trên sẽ điều chế được bao nhiêu lọ đựng đầy khí có dung tích 200ml
a)
2KClO3 \(\underrightarrow{MnO_2}\) 2KCl + 3O2
nKClO3 = 5,46875 : 122,5 ≃ 0,045 mol
Hiệu xuất phản ứng bằng 80% => nO2 = 0,045.3/2.80% = 0,053 mol
=> VO2 = 0,053 .22,4 = 1,2 lít.
b) Với lượng hóa chất như trên ta điều chế được 1,2 lít oxi <=> 6 lọ 200ml
Đúng 1
Bình luận (0)
Trộn 1,12 lít H2 và 2,24 lít khí O2(đktc) rồi đem đốt cháy.
a) Viết phương trình hóa học?
b) Hỏi sau phản ứng khí nào dư, dư bao nhiêu lít?
c) Tính khối lượng nước tạo thành sau phản ứng?
a. \(n_{H_2}=\dfrac{1.12}{22,4}=0,05\left(mol\right)\)
\(n_{O_2}=\dfrac{2.24}{22,4}=0,1\left(mol\right)\)
PTHH : 2H2 + O2 ---to---> 2H2O
0,05 0,025 0,05
b. Ta thấy : 0,05 < 0,1 => H2 đủ , O2 dư
\(V_{O_2\left(dư\right)}=\left(0,1-0,025\right).22,4=1,68\left(l\right)\)
c. \(m_{H_2O}=0,05.18=0,9\left(g\right)\)
Đúng 3
Bình luận (0)
Ta có
nH2 = 1,12 / 22,4 = 0,05 ( mol )
nO2 = 0,1 ( mol )
2H2 + O2 ---to ---> 2H2O
có : 0,05 0,1
pư : 0,05 0,025 0,05
dư : 0 0,075
Xét tỉ lệ : 0,05 / 2 < 0,1 / 1 , ta được O2 dư
=> nO2 dư = 0,1 - 0,025 = 0,075 ( mol )
=> V = 0,075 . 22,4 = 1,68 ( l )
mH2O = 0,05 . 18 = 0,9 ( g )
Đúng 2
Bình luận (0)
Trộn đều 36 gam hỗn hợp bột X gồm MgCO3 và kim loại R có hóa trị không đối rồi chia làm hai phần bằng nhau. - Phần 1: đem đốt nóng trong không khí. Sau khi các phản ứng xảy ra hoàn toàn thủ được 16,2 gam hỗn hợp các oxit kim loại. Phần 2: để hòa tan hết cần vừa đủ 500 ml dung dịch hỗn hợp HCI 1,2M và H2SO4 0,3M. Sau phản ứng thu được dung dịch A và V lít khí B (dktc). a. Xác định kim loại R. b. Tính tỉ khối của B so với H2. c,Ch...
Đọc tiếp
Trộn đều 36 gam hỗn hợp bột X gồm MgCO3 và kim loại R có hóa trị không đối rồi chia làm hai phần bằng nhau. - Phần 1: đem đốt nóng trong không khí. Sau khi các phản ứng xảy ra hoàn toàn thủ được 16,2 gam hỗn hợp các oxit kim loại. Phần 2: để hòa tan hết cần vừa đủ 500 ml dung dịch hỗn hợp HCI 1,2M và H2SO4 0,3M. Sau phản ứng thu được dung dịch A và V lít khí B (dktc). a. Xác định kim loại R. b. Tính tỉ khối của B so với H2. c,Cho 68,5 gam Ba kim loại vào dung dịch A. Sau khi các phản ứng kết thúc, lọc được m gam chất rắn F không tan. Tính giá trị của m.
Cho các chất sau : KCl,
CaCl
2
,
MnO
2
, dung dịch
H
2
SO
4
đặc. Đem trộn 2 hoặc 3 chất với nhau. Trộn như thế nào thì tạo thành clo ? Trộn như thế nào thì tạo thành hiđro clorua ? Viết PTHH của các phản ứng.
Đọc tiếp
Cho các chất sau : KCl, CaCl 2 , MnO 2 , dung dịch H 2 SO 4 đặc. Đem trộn 2 hoặc 3 chất với nhau. Trộn như thế nào thì tạo thành clo ? Trộn như thế nào thì tạo thành hiđro clorua ? Viết PTHH của các phản ứng.
+ Để tạo thành clo thì trộn KCl hoặc CaCl 2 với MnO 2 và H 2 SO 4 đặc
2KCl + H 2 SO 4 (đặc) → t ° K 2 SO 4 + 2HCl
MnO 2 + 4HCl → t ° MnCl 2 + Cl 2 + 2 H 2 O
+ Để tạo thành hiđro clorua thì trộn KCl hoặc CaClO với H 2 SO 4 đặc
Ca Cl 2 + 2 H 2 SO 4 → t ° Ca HSO 4 2 + 2HCl
Đúng 0
Bình luận (0)
Hoà tan hoàn toàn m gam bột nhôm trong dung dịch chứa HCl và HNO3 thu được 3,36 lít hỗn hợp Y gồm hai khí không màu, dung dịch còn lại chỉ chứa muối của cation Al3+. Đem toàn bộ lượng hỗn hợp khí Y trộn với 1 lít oxi thu được 3,688 lít hỗn hợp gồm 3 khí. Biết thể tích các khí đều đo ở đktc và khối lượng của hỗn hợp khí Y nhỏ hơn 2 gam. Tìm m. A. 9,72 gam. B. 8,10 gam. C. 3,24 gam. D. 4,05 gam.
Đọc tiếp
Hoà tan hoàn toàn m gam bột nhôm trong dung dịch chứa HCl và HNO3 thu được 3,36 lít hỗn hợp Y gồm hai khí không màu, dung dịch còn lại chỉ chứa muối của cation Al3+. Đem toàn bộ lượng hỗn hợp khí Y trộn với 1 lít oxi thu được 3,688 lít hỗn hợp gồm 3 khí. Biết thể tích các khí đều đo ở đktc và khối lượng của hỗn hợp khí Y nhỏ hơn 2 gam. Tìm m.
A. 9,72 gam.
B. 8,10 gam.
C. 3,24 gam.
D. 4,05 gam.
Hoà tan hoàn toàn m gam bột nhôm trong dung dịch chứa HCl và HNO3 thu được 3,36 lít hỗn hợp Y gồm hai khí không màu, dung dịch còn lại chỉ chứa muối của cation Al3+. Đem toàn bộ lượng hỗn hợp khí Y trộn với 1 lít oxi thu được 3,688 lít hỗn hợp gồm 3 khí. Biết thể tích các khí đều đo ở đktc và khối lượng của hỗn hợp khí Y nhỏ hơn 2 gam. Tìm m. A. 9,72 gam. B. 3,24 gam. C. 8,10 gam. D. 4,05 gam.
Đọc tiếp
Hoà tan hoàn toàn m gam bột nhôm trong dung dịch chứa HCl và HNO3 thu được 3,36 lít hỗn hợp Y gồm hai khí không màu, dung dịch còn lại chỉ chứa muối của cation Al3+. Đem toàn bộ lượng hỗn hợp khí Y trộn với 1 lít oxi thu được 3,688 lít hỗn hợp gồm 3 khí. Biết thể tích các khí đều đo ở đktc và khối lượng của hỗn hợp khí Y nhỏ hơn 2 gam. Tìm m.
A. 9,72 gam.
B. 3,24 gam.
C. 8,10 gam.
D. 4,05 gam.
Đáp án : B
nY = 0,15 mol giả sử gồm khí A và B
Vì VY + VO2 > V3 khí sau trộn => có phản ứng
=> Y có NO(A) : NO + ½ O2 à NO2
=> nO2 pứ = 1 + 3,36 – 3,688 = 0,672 ( < 1 lit ) ( O2 dư )
=> nNO = 0,06 mol => nB = 0,09 mol
Vì mY < 2 => MB < 18,3 => B là H2
Bảo toàn e : 3nAl = 2nH2 + 3nNO => nAl = 0,12 mol
=> m = 3,24g
Đúng 0
Bình luận (0)
Trộn 200ml dung dịch Al2(SO4)3 0,1M với V lít dung dịch HCl 1M thu được dung dịch X. Cho 0,12 mol Ba vào dung dịch X, sau phản ứng hoàn toàn lọc lấy kết tủa đem nung trong không khí đến khối lượng không đổi thu được 15 gam chất rắn.
a. Viết các phương trình phản ứng xảy ra.
b. Tính giá trị lớn nhất của V.
Nhanh giúp mình với ạ.
Trộn 200ml dung dịch Al2(SO4)3 0,1M với V lít dung dịch HCl 1M thu được dung dịch X. Cho 0,12 mol Ba vào dung dịch X, sau phản ứng hoàn toàn lọc lấy kết tủa đem nung trong không khí đến khối lượng không đổi thu được 15 gam chất rắn.
a. Viết các phương trình phản ứng xảy ra.
b. Tính giá trị lớn nhất của V.
Giúp mình vớiii, cảm ơn các bạn!
nAl2(SO4)3 = 0,02 và nBa = 0,12
nBaSO4 = 0,06
=>nAl2O3 = \(\dfrac{15-mBaSO4}{102}\) = 0,01
=>nAl(OH)3 = 0,02
Lượng H+ = V đạt giá trị lớn nhất khi Al3+ chưa kết tủa hết.
nOH- = 0,12.2 = V + 0,02.3
=>V = 0,18 lít
Đúng 1
Bình luận (2)
Hòa tan hoàn toàn m gam bột nhôm trong dung dịch chứa HCl và HNO3 thu được 3,36 lít hỗn hợp Y gồm hai khí không màu, dung dịch còn lại chỉ chứa muối của cation Al3+. Đem toàn bộ lượng hỗn hợp khí Y trộn với 1 lít oxi thu được 3,688 lít hỗn hợp gồm 3 khí. Biết thể tích các khí đều đo ở điều kiện tiêu chuẩn và khối lượng của hỗn hợp khí Y nhỏ hơn 2 gam. Giá trị của m là: A. 9,72 gam B. 8,10gam C. 3,24 gam D. 4,05 gam.
Đọc tiếp
Hòa tan hoàn toàn m gam bột nhôm trong dung dịch chứa HCl và HNO3 thu được 3,36 lít hỗn hợp Y gồm hai khí không màu, dung dịch còn lại chỉ chứa muối của cation Al3+. Đem toàn bộ lượng hỗn hợp khí Y trộn với 1 lít oxi thu được 3,688 lít hỗn hợp gồm 3 khí. Biết thể tích các khí đều đo ở điều kiện tiêu chuẩn và khối lượng của hỗn hợp khí Y nhỏ hơn 2 gam. Giá trị của m là:
A. 9,72 gam
B. 8,10gam
C. 3,24 gam
D. 4,05 gam.
Cho 1.08g hỗn hợp A gồm Na và Na2O tác dụng với 18.94g nước dư thu được dung dịch B và khí H2. Đem khí H2 vừa thu được trộn với khí CH4 thì được hỗn hợp D đốt cháy hoàn toàn hỗn hợp khí D trên cần 0.784l O2(đktc) và thu được lượng khí CO2 đúng bằng lượng CO2 thu được khi đốt cháy hoàn toàn 0.18g C1. Viết các phương trình phản ứng2. Tính số gam Na và số gam Na2O trong hỗn hợp A3. Tính C% của chất trong dung dịch B4. Trộn dung dịch B với 40g dung dịch NaOH nồng độ 10%.Hỏi thu được dung dịch có nồn...
Đọc tiếp
Cho 1.08g hỗn hợp A gồm Na và Na2O tác dụng với 18.94g nước dư thu được dung dịch B và khí H2. Đem khí H2 vừa thu được trộn với khí CH4 thì được hỗn hợp D đốt cháy hoàn toàn hỗn hợp khí D trên cần 0.784l O2(đktc) và thu được lượng khí CO2 đúng bằng lượng CO2 thu được khi đốt cháy hoàn toàn 0.18g C
1. Viết các phương trình phản ứng
2. Tính số gam Na và số gam Na2O trong hỗn hợp A
3. Tính C% của chất trong dung dịch B
4. Trộn dung dịch B với 40g dung dịch NaOH nồng độ 10%.Hỏi thu được dung dịch có nồng độ bao nhiêu phần trăm