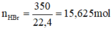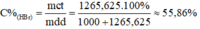1. Để hòa tan hết a gam Na2CO3 cần dùng 300 gam dd axit axetic thu được 8,4 lít khí cacbon ddiooxxit đo ở điều kiện tiêu chuẩn
a. Viết pthh xảy ra
b. Tìm a và tính nồng độ phần trăm của axit axetic đã dùng
2. Cho kim loại magie tác dụng với dung dịch có chứa 4,8 gam axit axetic
a. Tính khối lượng muối thu được sau phản ứng
b. Nếu đem toàn bộ lượng axit trên đun nóng với 11,5 ml rượu etylic 45 độ ( khối lượng riêng 0,8 g/mol ) có mặt H2SO4 đặc thì hệu suất phản ứng là bao nhiêu ?
3. Cho 30g hỗn hợp Y gồm rượu etylic và axit axetic . Cho hỗn hợp trên phản ứng với CaCO3 dư thì sau phản ứng thu được 3,36 lít khí ( đktc )
a. Viết phương trình hóa học xảy ra
b. Tính phần trăm khối lượng mỗi chất trong hỗn hợp ban đầu
Các bạn ơi giúp mình giải mấy bài này nhe thứ 3 mình kiểm tra rồi