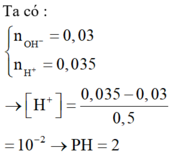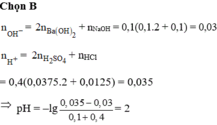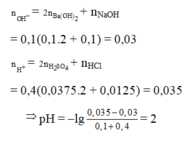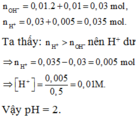trộn 100 dung dịch BA(OH)2 0.06 M với 400 ml dung dịch hcl 0.02M . tính pH

Những câu hỏi liên quan
Trộn 100 ml dung dịch NaOH 0,2M với 400 ml dung dịch Ba(OH)2 0,1M thu được dung dịch A. Tính pH dung dịch A Cho 500 ml dung dịch HCl 0,3 M vào 500 ml dung dịch A thu được dung dịch B. Tính pH dung dịch B
Trộn 100 ml dung dịch gồm Ba(OH)2 0,1M và NaOH 0,1M với 400 ml dung dịch gồm H2SO4 0,0375 M và HCl 0,0125 M thu được dung dịch X. Tính pH của dung dịch X .
H+ + OH- ® H2O
Tổng số mol OH-: (0,1.2 + 0,1).0,1 = 0,03 mol
Tổng số mol H+ : (0,0375.2 + 0,0125).0,4 = 0,035 mol
Số mol H+ dư: 0,035 – 0,03 = 0,005 mol ® [H+]= 0,01M ® pH = 2
Ví dụ 2. Cho dung dịch A là một hỗn hợp: H2SO4 2.10-4M và HCl 6.10-4M Cho dung dịch B là một hỗn hợp: NaOH 3.10-4M và Ca(OH)2 3,5.10-4M
a) Tính pH của dung dịch A và dung dịch B
b) Trộn 300ml dung dịch A với 200ml dung dịch B được dung dịch C. Tính pH của dung dịch C.
Đúng 0
Bình luận (0)
Tính pH của các dung dịch sau :
a.Trộn 100 ml dung dịch HCl 0,12M với 100 ml dung dịch H2SO4 0,04M. Tính pH của dung dịch X thu được .
b. Trộn 100 ml dung dịch KOH 0,12M với 100 ml dung dịch Ba(OH)2 0,04M. Tính pH của dung dịch thu được .
a) \(n_{H^+}=n_{HCl}+2n_{H_2SO_4}=0,1\cdot0,12+0,1\cdot0,04=0,016\)
\(C_M=\dfrac{0,016}{0,2}=0,08M\)
\(\Rightarrow pH=-log\left(0,08\right)=1,1\)
b) \(n_{OH^-}=n_{KOH}+2n_{Ba\left(OH\right)_2}=0,012+2\cdot0,004=0,02\)
\(C_M=\dfrac{0,02}{0,2}=0,1\)
\(\Rightarrow pH=-log\left(\dfrac{10^{-14}}{0,1}\right)=13\)
Đúng 0
Bình luận (0)
Trộn 100 ml dung dịch (gồm Ba(OH)2 0,1M và NaOH 0,1M) với 400 ml dung dịch (gồm H2SO4 0,0375M và HCl 0,0125M), thu được dung dịch X. Giá trị pH của dung dịch X là A. 7 B. 2 C. 1. D. 6
Đọc tiếp
Trộn 100 ml dung dịch (gồm Ba(OH)2 0,1M và NaOH 0,1M) với 400 ml dung dịch (gồm H2SO4 0,0375M và HCl 0,0125M), thu được dung dịch X. Giá trị pH của dung dịch X là
A. 7
B. 2
C. 1.
D. 6
Đáp án B
nOH- = 0,1.2.0,1 + 0,1.0,1 = 0,03
nH+ = 0,4.2.0,0375 + 0,4.0,0125 = 0,035
⇒ Trong X có H+ dư
⇒ nH+/X =0,035 – 0,03 = 0,005; VX = 100 + 400 = 500ml
⇒ [H+] = 0,01 ⇒ pH = 2.
Đúng 0
Bình luận (0)
Trộn 100 ml dung dịch gồm Ba(OH)2 0,1M và NaOH 0,1M với 400 ml dung dịch gồm: H2SO4 0,0375M và HCl 0,0125M thu được dung dịch X. Giá trị pH của X là A. 1 B. 2 C. 6 D. 7
Đọc tiếp
Trộn 100 ml dung dịch gồm Ba(OH)2 0,1M và NaOH 0,1M với 400 ml dung dịch gồm: H2SO4 0,0375M và HCl 0,0125M thu được dung dịch X. Giá trị pH của X là
A. 1
B. 2
C. 6
D. 7
Trộn 100 ml dung dịch A (gồm Ba(OH)2 0,1M và NaOH 0,1M) với 400 ml dung dịch B (gồm H2SO4 0,0375M và HCl 0,0125M), thu được dung dịch X. Giá trị pH của dung dịch X là
A. 1
B. 2
C. 12
D. 13
Trộn 100 ml dung dịch X (gồm Ba(OH)2 0,1M và NaOH 0,1M) với 400 ml dung dịch Y (gồm H2SO4 0,0375M và HCl 0,0125M) thu được dung dịch Z. Giá trị pH của dung dịch Z là: A. 1. B. 2. C. 6. D. 7
Đọc tiếp
Trộn 100 ml dung dịch X (gồm Ba(OH)2 0,1M và NaOH 0,1M) với 400 ml dung dịch Y (gồm H2SO4 0,0375M và HCl 0,0125M) thu được dung dịch Z. Giá trị pH của dung dịch Z là:
A. 1.
B. 2.
C. 6.
D. 7
Trộn 100 ml dung dịch X (gồm Ba(OH)2 0,1M và NaOH 0,1M) với 400 ml dung dịch Y (gồm H2SO4 0,0375M và HCl 0,0125M) thu được dung dịch Z. Giá trị pH của dung dịch Z là:
A. 1.
B. 2.
C. 6.
D. 7.
Trộn 100 ml dung dịch (gồm Ba(OH)2 0,1M và NaOH 0,1M) với 400 ml dung dịch (gồm H2SO4 0,0375M và HCl 0,0125M) thu được dung dịch X có giá trị pH của X là: A. 1. B. 2. C. 7. D. 6.
Đọc tiếp
Trộn 100 ml dung dịch (gồm Ba(OH)2 0,1M và NaOH 0,1M) với 400 ml dung dịch (gồm H2SO4 0,0375M và HCl 0,0125M) thu được dung dịch X có giá trị pH của X là:
A. 1.
B. 2.
C. 7.
D. 6.