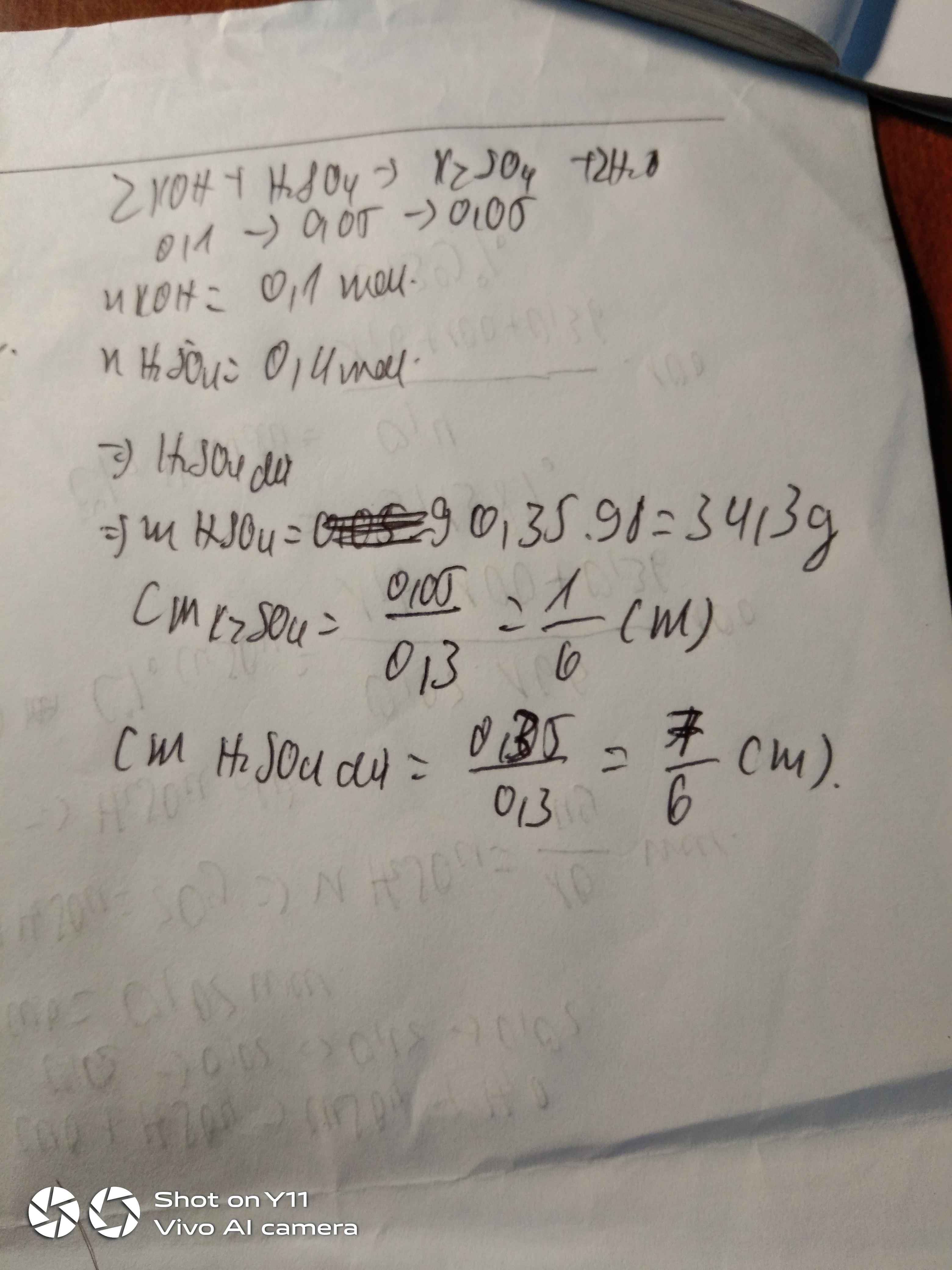Tìm nồng độ % của 200g dd H2SO4 có thể tích 100ml và nồng độ Mol 2M

Những câu hỏi liên quan
cho 100ml dd KOH 1M phản ứng với 200ml dd H2SO4 nồng độ 2M a) hỏi sau phản ứng chất nào dư, dư bao nhiêu b) tính nồng độ mol của dd sau phản ứng
Trung hoà 100ml dd CH3COOH có nồng độ a (M) bằng 200g dd NaOH 10% có D= 1,11 g/ml. Hãy tính (a) a (b) Thể tích dung dịch NaOH đã dùng (c) khối lượng muối thu được (d) nồng độ mol dd muối thu được sau pứ
Câu 16: trung hòa dd KOH 2M bằng 250 ml HCl 1,5
a) tính thể tích dd KOH cần dùng cho phản ứng
b) tính nồng độ mol của dd muối thu được sau phản ứng
Câu 18: trung hòa dd KOH 5,6℅ (D= 10,45g/ml ) bằng 200g dd H2SO4 14,7℅.
a) tính thể tích dd KOH cần dùng
b) tính C℅ của dd muối sau phản ứng
GIUP MINH 2 CAU NAY VOI!!!
Câu 16:
PTHH: \(KOH+HCl\rightarrow KCl+H_2O\)
Ta có: \(n_{HCl}=0,25\cdot1,5=0,375\left(mol\right)=n_{KOH}=n_{KCl}\)
\(\Rightarrow\left\{{}\begin{matrix}V_{KOH}=\dfrac{0,375}{2}=0,1875\left(l\right)\\C_{M_{KCl}}=\dfrac{0,375}{0,1875+0,25}\approx0,86\left(M\right)\end{matrix}\right.\)
Đúng 3
Bình luận (0)
Câu 18:
PTHH: \(2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\)
a) Ta có: \(n_{H_2SO_4}=\dfrac{200\cdot14,7\%}{98}=0,3\left(mol\right)\)
\(\Rightarrow n_{KOH}=0,6\left(mol\right)\) \(\Rightarrow m_{ddKOH}=\dfrac{0,6\cdot56}{5,6\%}=600\left(g\right)\) \(\Rightarrow V_{ddKOH}=\dfrac{600}{10,45}\approx57,42\left(ml\right)\)
b) Theo PTHH: \(n_{K_2SO_4}=0,3\left(mol\right)\) \(\Rightarrow C\%_{K_2SO_4}=\dfrac{0,3\cdot174}{600+200}\cdot100\%=6,525\%\)
Đúng 4
Bình luận (0)
Câu 18 :
Khối lượng của axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{14,7.200}{100}=29,4\left(g\right)\)
Số mol của axit sunfuric
nH2SO4 = \(\dfrac{m_{H2SO4}}{M_{H2SO4}}=\dfrac{29,4}{98}=0,3\left(mol\right)\)
Pt : 2KOH + H2SO4 → K2SO4 + 2H2O\(|\)
2 1 1 2
0,3 0,3 0,3
a) Số mol của kali hidroxit
nKOH = \(\dfrac{0,3.2}{1}=0,6\left(mol\right)\)
Khối lượng của kali hidroxit
mKOH = nKOH . MKOH
= 0,6 . 56
= 33,6 (g)
Khối lượng của dung dịch kali hidroxit
C0/0KOH = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\dfrac{33,6.100}{5,6}=600\left(g\right)\)
Thể tích của dung dịch kali hidroxit cần dùng
D = \(\dfrac{m}{V}\Rightarrow V=\dfrac{m}{D}=\dfrac{600}{10,45}=57,42\left(ml\right)\)
b) Số mol của muối kali sunfat
nK2SO4 = \(\dfrac{0,3.1}{1}=0,3\left(mol\right)\)
Khối lượng của muối kali sunfat
mK2SO4 = nK2SO4 . MK2SO4
= 0,3 . 174
= 52,2 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mKOH + mH2SO4
= 600 + 200
= 800 (g)
Nồng độ phần trăm của muối kali sunfat C0/0K2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{52,2.100}{800}=6,525\)0/0
Chúc bạn học tốt
Đúng 1
Bình luận (0)
cho 5,4g Al vào 100ml dd H2SO4 0,5M . Thể tích khí H2 sinh ra(ở đktc) và nồng độ mol của dd sau pư là bao nhiêu?( giả sử thể tích dd thay đổi không đáng kể)
nAl=5,4:27=0,2mol
nH2SO4=0,05mol
PTHH: 2Al+3H2SO4=>Al2(SO4)3+3H2
0,2:0,05=> nAl dư theo nH2SO4
p/ư: 1/30<-0,05--->1/60-------->0,05
=> V(H2)=0,05.22,4=1,12ml
=> CM(Al2(SO4)3)=1/60:0,1=1/6M
Đúng 2
Bình luận (0)
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 ↑
Số mol của Al là: 5,4 : 27 = 0,2 (mol)
Đổi: 100 mol = 0,1 lít
Số mol của H2SO4 là: 0,5 . 0,1 = 0,05 (mol)
So sánh: \(\frac{0,2}{2}>\frac{0,05}{3}\) => Al dư, Tính theo H2SO4.
Số mol của H2 là: 0,05 . 3/3 = 0,05 (mol)
Thể tích của H2 là: 0,05 . 22,4 = 1,12 (lít)
Số mol của Al2(SO4)3 là: 0,05 . 1/3 = 1/60 (mol)
Vì thể tích dung dịch thay đổi k đáng kể nên V dung dịch sau pứ = 0,1 lít
Nồng độ mol của dd sau pứ là: 1/60 : 0,1 = 1/6M
Đúng 1
Bình luận (1)
nAl = 5,4/ 27= 0,2 (mol)
n H2SO4 = 0,5.0,1= 0,05( mol)
PTHH: 2Al + 3H2SO4 ---> Al2(SO4)3+ 3H2
Ta có tỉ lệ : 0,2/2 > 0,05/3 ---> sau phản ứng Al dư , H2SO4 hết
theo PTHH ta có n H2 = n H2SO4 = 0,05 (mol)
--> V H2 = 0,05 .22,4 = 1,12 (l)
theo PTHH n Al2 (SO4)3 = 1/3 n H2SO4 = 1/3 . 0,05 = 0,016( mol)
100ml = 0,1 l
---> CM [ AL2(SO4)3] = 0,016 / 0,1 = 0,16 (M)
Đúng 2
Bình luận (0)
Xem thêm câu trả lời
Trộn 100ml dd HCl 2M vào 200ml đ HCl 2M. Tìm Nồng độ mol của dd sau pha trộn
\(CM_{HCl\left(sau\right)}=\dfrac{n}{V}=\dfrac{0,1.2+0,2.2}{0,1+0,2}=2M\)
Đúng 0
Bình luận (0)
Cho 5,4g nhôm vào 100ml dd H2SO4 0,5M
Tính thể tích khí H2 sinh ra ở đktc
Tính nồng độ mol của các chất trong dd sau phản ứng . Cho rằng thể tích dd sau phản ứng thay đổi không đáng kể
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ n_{H_2SO_4}=0,5.0,1=0,05\left(mol\right)\\ pthh:2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(LTL:\dfrac{0,2}{2}>\dfrac{0,05}{3}\)
=> Al dư
\(n_{H_2}=n_{H_2SO_4}=0,05\left(mol\right)\)
\(V_{H_2}=0,05.22,4=1,12l\\
C_M=\dfrac{\dfrac{1}{60}}{0,1}=0,16M\)
Đúng 2
Bình luận (0)
cho 5,4g sắt vào 100ml dd h2SO4
a tính thể tích khí h2 sinh ra ở đktc
b tính nồng độ mol các chất trong dd sau phản ứng
Sửa đề cho dễ làm: "Cho 5,6 gam sắt"
PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Gộp cả phần a và b
Ta có: \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)=n_{FeSO_4}=n_{H_2}\)
\(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,1\cdot22,4=2,24\left(l\right)\\C_{M_{FeSO_4}}=\dfrac{0,1}{0,1}=1\left(M\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
-Mình sửa đề là 5,6 g sắt nhé :)
Đổi 100ml = 1lit
PTHH: Fe +H2SO4→FeSO4+H2
+nFe=\(\dfrac{5,6}{56}=0,1\left(mol\right)\)
-Theo PTHH ta có:
+nH2=nFe=0,1(mol)
+VH2=0,1.22,4=2,24(lit)
-Theo PTHH ta có:
+nH2SO4=nFe=0,1(mol)
+CMH2SO4=\(\dfrac{0,1}{0,1}=1\) (M)
Đúng 0
Bình luận (0)
100ml dd H3PO4 2M và 150ml dd NaOH 2,5M. Tính nồng độ mol muối
\(n_{H_3PO_4}=2.0,1=0,2\left(mol\right)\)
\(n_{NaOH}=2,5.0,15=0,375\left(mol\right)\)
PTHH: NaOH + H3PO4 --> NaH2PO4 + H2O
_______0,2<----0,2--------->0,2
NaH2PO4 + NaOH --> Na2HPO4 + H2O
0,175<-----0,175------>0,175
=> nNaH2PO4 = 0,025 (mol)
=> nNa2HPO4 = 0,175 (mol)
=> \(\left\{{}\begin{matrix}C_{M\left(Na_2HPO_4\right)}=\dfrac{0,175}{0,1+0,15}=0,7M\\C_{M\left(NaH_2PO_4\right)}=\dfrac{0,025}{0,1+0,25}=0,1M\end{matrix}\right.\)
Đúng 1
Bình luận (0)
Cho 100ml dd NaOH 2M vào 100ml dd H2SO4 . Tính nồng độ mol/l của dung dịch đã dùng.
giúp tui