hào tan 10g KNO3 vào 150g nước. Tính nồng độ % của dung dịch

Những câu hỏi liên quan
Hòa tan 7,8 gam một kim loại R vào nước thu được 100ml dung dịch D và 2,24 lít H2 (đktc). Vậy R và nồng độ mol của dung dịch D là:
A. Na và 1M.
B. K và 2M.
C. K và 1M.
D. K và 1,5M.
Đáp án B
Số mol H2 = 0,1 mol
Phương trình phản ứng:
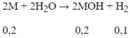
Tính được M = m : n = 7,8 : 0,2 = 39. Vậy kim loại cần tìm là K.
C M = 0 , 2 0 , 1 = 2 M
Đúng 0
Bình luận (0)
Hòa tan 12g MgO 150g dung dịch HCl 14,6%. Tính nồng độ phần trăm các chất trong dung dịch thu được.
nMgO=\(\frac{12}{24+16}=0,3\) mol
mHCl = \(\frac{150.14,6}{100}=21,9\)g=> nHCl=\(\frac{21,9}{36,5}=0,6\) mol
PTHH: MgO+2HCl --> MgCl2+ H2O
0,3mol: 0,6mol----->0,3 mol--> ,0,3 mol
mMgCl2=0,3.( 24+35,5.2)=28,5g
theo định luật bảo toàn khối lượng
m MgCl2 =mMgO+mHCl-mH2O=12+150-0,3(1.2+16)=156,6 g
=> C% MgCl2\(=\frac{28,5}{156,6}.100=18,2\)%
Đúng 0
Bình luận (0)
hòa tan hoàn toàn 13,2(g) hỗn hợp hai bột ZnO và Al2O3 vào 250 (ml) dung dịch HCl 2M (vừa đủ)
a) tính thành phần % theo khối lượng mỗi chất trong hỗn hợp
b) tính nồng độ mol của các muối trong dung dịch sau phản ứng (thể tích dung dịch thay đổi không đáng kể)
Một dung dịch H2SO4 có nồng độ 14%. Tính khối lượng H2SO4 có trong 150g dung dung dịch?
\(m_{H_2SO_4}=\dfrac{14.150}{100}=21\left(g\right)\)
Đúng 3
Bình luận (0)
Cho 8g lưu huỳnh trioxit vào nước thu được 250ml dung dịch axit sunfuric
a. Viết PTHH
b. Xác định nồng độ CM của axit thu đc
a) Pt: SO3 + H2O => H2SO4
b) nSO3 = \(\dfrac{8}{80}=0,1mol\)
Theo pt: nH2SO4 = nSO3 = 0,1 mol
=> CMH2SO4 = 0,1 : 0,25 = 0,4M
Đúng 1
Bình luận (0)
a)pthh SO3 + H2O --> H2SO4
0,1 0,1 mol
b) nSO3=8/80=0,1mol
CM H2SO4 = 0,1/0,25=0,4 M
Đúng 0
Bình luận (0)
a) Pt: SO3 + H2O => H2SO4
b)số mol SO3 đem phản ứng là :
\(nSO_3=\dfrac{8}{80}=0,1mol\)
\(SO_3+H_2O\Rightarrow H_2SO_4\)
Theo phương trình:\(nH_2SO_4=nSo_3=0,1mol\)
\(\Rightarrow\)CMH2SO4=\(\dfrac{0,1}{0,25}=0,4M\)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
câu 1:a)hòa tan 20g KCl trong 600g dung dịch tính nồng độ % của KCl
b)hòa tan 1,5mol CuSO4 trong 750ml dung dịch tính nồng độ mol/l
câu 2:trong phòng thí nghiệm ngta dùng H2 để khử P2O3 thu đc 11,2(g)Fe
a)Viết PT pư xảy ra
b)tính khối lượng sắt (III) oxit tham gia phản ứng
1
a)C%=\(\dfrac{20}{620}100=3,225\%\)
b) CM=\(\dfrac{1,5}{0,75}=2M\)
2
3H2+Fe2O3-to>2Fe+3H2O
0,1----------0,2
n Fe=0,2 mol
=>m Fe2O3=0,1.160=16g
Đúng 1
Bình luận (0)
cho 5.4 gam Nhôm tác dụng vừa đủ với 200gam dung dịch HCl
a) tính thể tích khí H2 sinh ra (đktc)
b) Tính nồng độ phần trăm của dung dịch HCl đã dùng
c) tính nồng độ phần trăm của dung dịch thu được sau phản ứng
Theo gt ta có: $n_{Al}=0,2(mol)$
$2Al+6HCl\rightarrow 2AlCl_3+3H_2$
a, Ta có: $n_{H_2}=0,3(mol)\Rightarrow V_{H_2}=6,72(l)$
b, Ta có: $n_{HCl}=0,6(mol)\Rightarrow \%C_{HCl}=10,95\%$
c, Sau phản ứng dung dịch chứa 0,2 mol AlCl3
Suy ra $\%C_{AlCl_3}=13,03\%$
Đúng 1
Bình luận (0)
Tính theo PTHH, lượng dư, Nồng độ dung dịch?cho 11,2g sắt tác dụng với 400ml dung dịch HCLa, Tính thể tích H2 sinh ra ở đktc?b, Tính nồng độ mol của dung dịch HCL đã dùng ?c, Nếu dùng lượng H2 của phản ứng trên khử 8g CuO ở nhiệt độ cao. Hỏi thu đc bao nhiêu gam FeTrả LờinFe11.2560.2(o)nFe11.2560.2(mol)+ 0.2.......0.4...................0.2VH20.2⋅22.44.48(l)VH20.2⋅22.44.48(l) CMHCl0.40.41(M)CMHCl0.40.41(M)nCuO8800.1(mol)nCuO8800.1(mol)CuO+H2t0→Cu+H2OCuO+H2t0→Cu+H...
Đọc tiếp
Tính theo PTHH, lượng dư, Nồng độ dung dịch?
cho 11,2g sắt tác dụng với 400ml dung dịch HCL
a, Tính thể tích H2 sinh ra ở đktc?
b, Tính nồng độ mol của dung dịch HCL đã dùng ?
c, Nếu dùng lượng H2 của phản ứng trên khử 8g CuO ở nhiệt độ cao. Hỏi thu đc bao nhiêu gam Fe
Trả Lời
nFe=11.2\56=0.2(o)nFe=11.2\56=0.2(mol)
+
0.2.......0.4...................0.2
VH2=0.2⋅22.4=4.48(l)VH2=0.2⋅22.4=4.48(l)
CMHCl=0.4\0.4=1(M)CMHCl=0.4\0.4=1(M)
nCuO=8\80=0.1(mol)nCuO=8\80=0.1(mol)
CuO+H2t0→Cu+H2OCuO+H2t0→Cu+H2O
1............11............1
0.1.........0.20.1.........0.2
LTL:0.11<0.21⇒H2dưLTL:0.11<0.21⇒H2dư
nCu=nCuO=0.1(mol)nCu=nCuO=0.1(mol)
mCu=0.1⋅64=6.4(g)
CHO HỎi
NFe = 11.2\56 = 0,2 mol thì 56 lấy đâu ra ạ
56 là nguyên tử khối cùa Fe nhé , em có thể xem lại trong bảng.
Đúng 1
Bình luận (0)
Tính theo PTHH, lượng dư, Nồng độ dung dịch?
cho 11,2g sắt tác dụng với 400ml dung dịch HCL
a, Tính thể tích H2 sinh ra ở đktc?
b, Tính nồng độ mol của dung dịch HCL đã dùng ?
c, Nếu dùng lượng H2 của phản ứng trên khử 8g CuO ở nhiệt độ cao. Hỏi thu đc bao nhiêu gam Fe
\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(0.2.......0.4...................0.2\)
\(V_{H_2}=0.2\cdot22.4=4.48\left(l\right)\)
\(C_{M_{HCl}}=\dfrac{0.4}{0.4}=1\left(M\right)\)
\(n_{CuO}=\dfrac{8}{80}=0.1\left(mol\right)\)
\(CuO+H_2\underrightarrow{^{t^0}}Cu+H_2O\)
\(1............1\)
\(0.1.........0.2\)
\(LTL:\dfrac{0.1}{1}< \dfrac{0.2}{1}\Rightarrow H_2dư\)
\(n_{Cu}=n_{CuO}=0.1\left(mol\right)\)
\(m_{Cu}=0.1\cdot64=6.4\left(g\right)\)
Chúc em học tốt và có những trải nghiệm tuyệt vời tại hoc24.vn nhé !
Đúng 1
Bình luận (1)
a) nFe=0,2(mol)
PTHH: Fe + 2HCl -> FeCl2 + H2
0,2_________0,4____0,2___0,2(mol)
V(H2,dktc)=0,2.22,4=4,48(l)
b) VddHCl=0,4/0,4=1(l)
c) nCuO=0,1(mol)
PTHH: CuO + H2 -to-> Cu + H2O
Ta có: 0,2/1 > 0,1/1
=> CuO hết, H2 dư, tính theo nCuO
-> nCu=nCuO=0,1(mol)
=>mCu=0,1.64=6,4(g)
Đúng 0
Bình luận (0)
CMHCl=0.40.4=1(M)CMHCl=0.40.4=1(M)
LTL:0.11<0.21⇒H2dưLTL:0.11<0.21⇒H2dư
nCu=nCuO=0.1(mol)nCu=nCuO=0.1(mol)
mCu=0.1⋅64=6.4(g)
Đúng 0
Bình luận (0)























