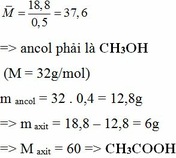dẫn 6.72 lit 1 hh khí gồm 2 hidocacbon mạch hở qua dd br dư sao cho p.ứ xảy ra hoàn toàn, sau p.ứ tháy khối lượg bìh đựg br tăng thêm 5.6g, đồg thời thoát ra 2.24lit 1 chất khí. mặt khác đem đốt 2.24lit (dktc)còn lai o tren thay tạo ra 11.2 lit(dktc) khí co2 .Xđ ctpt của 2 hidrocacbon. tính t.phần % thể tích mỗi khí trog hh. giải dùm e ạ

Những câu hỏi liên quan
dẫn 6.72 lit 1 hh khí gồm 2 hidocacbon mạch hở qua dd br dư sao cho p.ứ xảy ra hoàn toàn, sau p.ứ tháy khối lượg bìh đựg br tăng thêm 5.6g, đồg thời thoát ra 2.24lit 1 chất khí. Xđ ctpt của 2 hidrocacbon. tính t.phần % thể tích mỗi khí trog hh
-Thể tích khí đã td với dung dịch br : 6.72 - 2.24 = 4.48 (lít) ( 6.72 là số lít của hỗn hợp 2 hiddrocacbon mạch hở; 2.24 là khí đã thoát ra sau phản ứng) ( cái này áp dụng định luật bảo toàn khối lượng í, vì có khí thoát ra nên phải trừ đi)
-từ đó ta có thể suy ra số mol khí phản ứng với dung dịch brom là
4.4822.4=0.2(mol)4.4822.4=0.2(mol) (4.48 là Thể tích khí đã td với dung dịch br mà chúng ta tính được ở câu trên; theo công thức thì n=V22.4n=V22.4
>> tức là ta đã tính được số mol khí đã pư với dung dịch brom
- khối lượng của dung dịch brom tăng lên 5.6 gam, đó là do khối lượng của hidrocacbon bị hấp thụ ( Br+hidrocacbon )>> nói chung 5.6 là khối lượng của hidrocacbon
Nên từ đó ta có thể suy ra khối lượng mol của hidrocacbon là : 5.60.2=28(g)5.60.2=28(g) (theo công thức M=m\n)
Rồi bạn biện luận thôi, nếu C..... thì.......và kết hợp với H ...... Nói chung là ko cho phép phân tử khối của hidrocacbon đó vượt quá 28 ⇒C2H4⇒C2H4
Ta thấy ở trên đó chỉ có 1 hidrocacbon tham gia pư thôi, vậy hidrocacbon này ko pu với Brm bạn ghi phương trình phản ứng là CxHy + o2 rồi tính theo phương trình đốt cháy( cũng đơn giảm thôi, bạn ghi ra sẽ biết) ⇒Ct:CH4
Còn lại tính % thể tích thì theo công thức thôi
Đúng 0
Bình luận (0)
-Thể tích khí đã td với dung dịch br : 6.72 - 2.24 = 4.48 (lít) ( 6.72 là số lít của hỗn hợp 2 hiddrocacbon mạch hở; 2.24 là khí đã thoát ra sau phản ứng) ( cái này áp dụng định luật bảo toàn khối lượng í, vì có khí thoát ra nên phải trừ đi)
-từ đó ta có thể suy ra số mol khí phản ứng với dung dịch brom là
4.48/22.4=0.2(mol)(4.48 là Thể tích khí đã td với dung dịch br mà chúng ta tính được ở câu trên; theo công thức thì n=V/22.4n
>> tức là ta đã tính được số mol khí đã pư với dung dịch brom
- khối lượng của dung dịch brom tăng lên 5.6 gam, đó là do khối lượng của hidrocacbon bị hấp thụ ( Br+hidrocacbon )>> nói chung 5.6 là khối lượng của hidrocacbon
Nên từ đó ta có thể suy ra khối lượng mol của hidrocacbon là : 5.6/0.2=28(g) (theo công thức M=m\n)
Rồi bạn biện luận thôi, nếu C..... thì.......và kết hợp với H ...... Nói chung là ko cho phép phân tử khối của hidrocacbon đó vượt quá 28 ⇒C2H4
Ta thấy ở trên đó chỉ có 1 hidrocacbon tham gia pư thôi, vậy hidrocacbon này ko pu với Brm bạn ghi phương trình phản ứng là CxHy + o2 rồi tính theo phương trình đốt cháy( cũng đơn giảm thôi, bạn ghi ra sẽ biết) ⇒Ct:CH4
Còn lại tính % thể tích thì theo công thức thôi
Đúng 0
Bình luận (1)
Giải:
Thể tích khí đã tác dụng với dung dịch brom là : 6,72 – 2,24 = 4,48 (lít).
=> Số mol khí phản ứng với dung dịch brom là : \(\dfrac{4,48}{22,4}=0,2(mol)\)
Khối lượng bình brom tăng lên là do khối lượng hiđrocacbon bị hấp thụ. Vậy khối lượng mol phân tử của hiđrocacbon là : \(\dfrac{5,6}{0,2}=28\left(\text{gam/mol}\right)\)
=> Công thức phân tử của một hiđrocacbon là C2H4.
Dựa vào phản ứng đốt cháy tìm được hiđrocacbon còn lại là CH4.
\(\%V_{C_2H_4}=\dfrac{4,48}{6,72}.100=66,67\%\)
\(\%V_{CH_4}=100-66,67\%=33,33\%\)
Đúng 0
Bình luận (0)
dẫn 11.2 hh khí x gồm metan và etilen đi qua Br2 dư thấy bình Br tăng 5.6g khí thoát ra đốt cháy hoàn toàn cần V lít oxi các khí đo ở đktc tính khối lượn mỗi khí trong X và tính giá trị V
Xem chi tiết
\(m_{C_2H_4}=5.6\left(g\right)\)
\(n_{C_2H_4}=\dfrac{5.6}{28}=0.2\left(mol\right)\)
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
\(V_{CH_4}=11.2-0.2\cdot22.4=6.72\left(l\right)\)
\(n_{CH_4}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(m_{CH_4}=0.3\cdot16=4.8\left(g\right)\)
\(CH_4+2O_2\underrightarrow{t^0}CO_2+2H_2O\)
\(C_2H_4+3O_2\underrightarrow{t^0}2CO_2+2H_2O\)
\(V_{O_2}=\left(0.3\cdot2+0.2\cdot3\right)\cdot22.4=26.88\left(l\right)\)
Đúng 2
Bình luận (0)
Cho hh khí A gồm 2 hidrocacbon mạch hở
Dẫn 336ml hh khí A vào bình đựng dd Brom dư, thấy thoát ra 112ml khí, đồng thười khối lượng bình đựng dd brom tăng 0,54g
Mặt khác, đốt cháy 336ml hh khí A cần 1,624 lít khí oxi
Xác định CTPT, viết CTCT có thể có của các chất trong hh A
Các pứ xảy ra hoàn toàn và đo bằng đktc
A chứa 1 hidrocacbon no (X) và 1 hidrocacbon không no (Y)
=> (X) là ankan
- Xét TN1:
\(n_Y=\dfrac{0,336-0,112}{22,4}=0,01\left(mol\right)\)
=> \(M_Y=\dfrac{0,54}{0,01}=54\left(g/mol\right)\)
=> Y là C4H6
- Xét TN2:
CTPT của X là CnH2n+2
\(n_X=\dfrac{0,112}{22,4}=0,005\left(mol\right)\)
\(n_{O_2}=\dfrac{1,624}{22,4}=0,0725\left(mol\right)\)
PTHH: 2C4H6 + 11O2 --to--> 8CO2 + 6H2O
0,01-->0,055
CnH2n+2 + \(\dfrac{3n+1}{2}\)O2 --to--> nCO2 + (n+1)H2O
0,005-->\(0,005.\dfrac{3n+1}{2}\)
=> \(0,005\dfrac{3n+1}{2}=0,0725-0,055=0,0175\)
=> n = 2
=> CTPT của (X): C2H6
CTCT của (X): \(CH_3-CH_3\)
CTCT của (Y):
(1) \(CH\equiv C-CH_2-CH_3\)
(2) \(CH_3-C\equiv C-CH_3\)
(3) \(CH_2=C=CH-CH_3\)
(4) \(CH_2=CH-CH=CH_2\)
Đúng 0
Bình luận (0)
Dẫn 6,72 lít một hỗn hợp khí gồm hai hiđrocacbon mạch hở (không phải mạch vòng) qua dung dịch brom dư sao cho phản ứng xảy ra hoàn toàn. Sau thí nghiệm, thấy khối lượng bình đựng dung dịch brom tăng thêm 5,6 gam, đồng thời thoát ra 2,24 lít một chất khí. Mặt khác, nếu đốt cháy toàn bộ 6,72 lít hỗn hợp trên thấy tạo ra 22 gam
CO
2
và 10,8 gam
H
2
O
. Biết các thể...
Đọc tiếp
Dẫn 6,72 lít một hỗn hợp khí gồm hai hiđrocacbon mạch hở (không phải mạch vòng) qua dung dịch brom dư sao cho phản ứng xảy ra hoàn toàn. Sau thí nghiệm, thấy khối lượng bình đựng dung dịch brom tăng thêm 5,6 gam, đồng thời thoát ra 2,24 lít một chất khí. Mặt khác, nếu đốt cháy toàn bộ 6,72 lít hỗn hợp trên thấy tạo ra 22 gam CO 2 và 10,8 gam H 2 O . Biết các thể tích khí đo ở đktc.
Xác định công thức phân tử của hai hiđrocacbon và tính thành phần % về thể tích của mỗi chất trong hỗn hợp
Thể tích khí đã tác dụng với dung dịch brom là : 6,72 - 2,24 = 4,48 (lít).
=> Số mol khí phản ứng với dung dịch brom là : 4,48/22,4 = 0,2 mol
Khối lượng bình brom tăng lên là do khối lượng hiđrocacbon bị hấp thụ. Vậy khối lượng mol phân tử của hiđrocacbon là :
5,6/0,2 = 28 (gam/mol)
=> Công thức phân tử của một hiđrocacbon là C 2 H 4
Dựa vào phản ứng đốt cháy tìm được hiđrocacbon còn lại là CH 4
% V C 2 H 4 = 4,48/6,72 x 100% = 66,67%; V CH 4 = 33,33%
Đúng 0
Bình luận (0)
Cho m gam hh bột Cu và Mg chia hh thành 2 phần bằng nhau:
- phần 1 đem nung nóng ngoài kk đến khi phản ứng xảy ra hoàn toàn thì thấy khối lượng hh tăng thêm 8g
- phần 2 đem hoà tan trong dd HCL dư thấy thoát ra 3,36 lít khí H2 ở đktc.tìm m
Giả sử: \(\left\{{}\begin{matrix}n_{Cu}=x\left(mol\right)\\n_{Mg}=y\left(mol\right)\end{matrix}\right.\) (trong 1 phần)
_ Phần 1:
PT: \(2Cu+O_2\underrightarrow{t^o}2CuO\)
\(2Mg+O_2\underrightarrow{t^o}2MgO\)
Ta có: m hỗn hợp tăng = mO2 \(\Rightarrow n_{O_2}=\dfrac{8}{32}=0,25\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{Cu}+\dfrac{1}{2}n_{Mg}=\dfrac{1}{2}x+\dfrac{1}{2}y\left(mol\right)\)
\(\Rightarrow x+y=0,5\left(1\right)\)
_ Phần 2: Cu không tác dụng với dd HCl.
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Ta có: \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Mg}=y\left(mol\right)\)
⇒ y = 0,15 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,35\left(mol\right)\\y=0,15\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m=2.\left(0,35.64+0,15.24\right)=52\left(g\right)\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (1)
Hỗn hợp X gồm một axit cacboxylic no, đơn chức, mạch hở và một ancol no, đơn chức, mạch hở. Cho m gam hỗn hợp X vào bình chứa Na dư thấy thoát ra 0,25 mol khí H2 và khối lượng bình tăng thêm 18,3 gam. Mặt khác, cho m gam hỗn hợp X vào bình chứa dung dịch NaHCO3 dư thấy thoát ra khí CO2 và khối lượng bình tăng thêm 14,4 gam. Giả thiết các phản ứng đều xảy ra hoàn toàn, các khí không tan trong nước và nước bay hơi không đáng kể. Xác định công thức của mỗi chất có trong hỗn hợp X.
Đọc tiếp
Hỗn hợp X gồm một axit cacboxylic no, đơn chức, mạch hở và một ancol no, đơn chức, mạch hở. Cho m gam hỗn hợp X vào bình chứa Na dư thấy thoát ra 0,25 mol khí H2 và khối lượng bình tăng thêm 18,3 gam. Mặt khác, cho m gam hỗn hợp X vào bình chứa dung dịch NaHCO3 dư thấy thoát ra khí CO2 và khối lượng bình tăng thêm 14,4 gam. Giả thiết các phản ứng đều xảy ra hoàn toàn, các khí không tan trong nước và nước bay hơi không đáng kể. Xác định công thức của mỗi chất có trong hỗn hợp X.
Cho m gam hỗn hợp M gồm đipeptit X, tripeptit Y, tetrapeptit Z và pentapeptit T (đều mạch hở) tác dụng với dung dịch NaOH vừa đủ thu được hỗn hợp Q gồm muối của Gly, Ala và Val. Đốt cháy hoàn toàn Q bằng một lượng oxi vừa đủ, thu lấy toàn bộ khí và hơi đem hấp thụ vào dung dịch Ca(OH)2 dư thấy khối lượng bình tăng 13,23 (gam) và có 0,84 lit khí thoát ra. Mặt khác, đốt cháy hoàn toàn m gam M, thu được 4,095 gam H2O. Giá trị m gần nhất với? A. 6,0 B. 6,5 C. 7,0 D. 7,5
Đọc tiếp
Cho m gam hỗn hợp M gồm đipeptit X, tripeptit Y, tetrapeptit Z và pentapeptit T (đều mạch hở) tác dụng với dung dịch NaOH vừa đủ thu được hỗn hợp Q gồm muối của Gly, Ala và Val. Đốt cháy hoàn toàn Q bằng một lượng oxi vừa đủ, thu lấy toàn bộ khí và hơi đem hấp thụ vào dung dịch Ca(OH)2 dư thấy khối lượng bình tăng 13,23 (gam) và có 0,84 lit khí thoát ra. Mặt khác, đốt cháy hoàn toàn m gam M, thu được 4,095 gam H2O. Giá trị m gần nhất với?
A. 6,0
B. 6,5
C. 7,0
D. 7,5
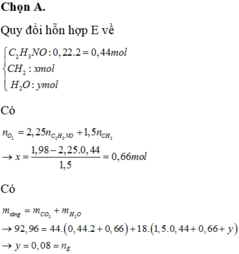
Hỗn hợp E chứa X, Y có tỉ lệ mol tương ứng
1 : 3 → X : 0,02 mol và Y :0,06 mol
Gọi số mắt xích của X,Y lần lượt là
n,m → n + m = 10
Và 0,02n + 0,06m = 0,44 → n =4 và m = 6
Gọi số C trong X và Y lần lượt là x1 và y1
( 8 ≤ x1 ≤ 20, 12≤ y1 ≤ 30)
→ x1.0,02 + y1.0,06 = 0,44. 2 + 0,66
→ x1 + 3y1 = 77
luôn có 6.2 = 12 ≤ y1 ≤ 77 /3 = 25,5
Lập bảng chọn giá trị x1 = 14(2Gly-2Val)
và y1 = 21 (3Gly-3Val)
Vậy thủy phân Y thu được 3 Gly và 3 Val
Đúng 0
Bình luận (0)
Cho m gam hỗn hợp M gồm đipeptit X, tripeptit Y, tetrapeptit Z và pentapeptit T (đều mạch hở) tác dụng với dung dịch NaOH vừa đủ thu được hỗn hợp Q gồm muối của Gly, Ala và Val. Đốt cháy hoàn toàn Q bằng một lượng oxi vừa đủ, thu lấy toàn bộ khí và hơi đem hấp thụ vào dung dịch
Ca
(
OH
)
2
dư thấy khối lượng bình tăng 13,23 (gam) và có 0,84 lit khí thoát ra. Mặt khác, đốt cháy hoàn toàn m gam M, thu được 4,095 gam...
Đọc tiếp
Cho m gam hỗn hợp M gồm đipeptit X, tripeptit Y, tetrapeptit Z và pentapeptit T (đều mạch hở) tác dụng với dung dịch NaOH vừa đủ thu được hỗn hợp Q gồm muối của Gly, Ala và Val. Đốt cháy hoàn toàn Q bằng một lượng oxi vừa đủ, thu lấy toàn bộ khí và hơi đem hấp thụ vào dung dịch Ca ( OH ) 2 dư thấy khối lượng bình tăng 13,23 (gam) và có 0,84 lit khí thoát ra. Mặt khác, đốt cháy hoàn toàn m gam M, thu được 4,095 gam H 2 O . Giá trị m gần nhất với?
A. 6,0
B. 6,5
C. 7,0
D. 7,5
Đáp án A.
nQ = 2 n N 2 = 0,075
Đốt Q thì n H 2 O - n C O 2 = 0 , 5 n Q 18 . n H 2 O + 44 . n C O 2 = 13 , 23 ⇒ n H 2 O = 0 , 24 n C O 2 = 0 , 2025
Đốt M thì
Bảo toàn nguyên tố Cacbon:
∑ n C O 2 ( t r o n g M ) = n C O 2 ( t r o n g Q ) + n N a 2 C O 3 = 0 , 24
⇒ n O 2 ( t r o n g Q ) = 1 , 5 . ∑ n C - 3 . n Q 4 . n Q = 0,30375
Mà n O 2 ( t r o n g Q ) = n C O 2 ( t r o n g M )
Bảo toàn khối lượng:
m M = 44 . n C O 2 + 18 . n H 2 O + 28 . n N 2 - 32 . n O 2 = 5 , 985 g a m
Đúng 0
Bình luận (0)
Cho m gam hỗn hợp M gồm đipeptit X, tripeptit Y, tetrapeptit Z và pentapeptit T (đều mạch hở) tác dụng với dung dịch NaOH vừa đủ thu được hỗn hợp Q gồm muối của Gly, Ala và Val. Đốt cháy hoàn toàn Q bằng một lượng oxi vừa đủ, thu lấy toàn bộ khí và hơi đem hấp thụ vào dung dịch Ca(OH)2 dư thấy khối lượng bình tăng 13,23 (gam) và có 0,84 lit khí thoát ra. Mặt khác, đốt cháy hoàn toàn m gam M, thu được 4,095 gam H2O. Giá trị m gần nhất với? A.6,0 B. 6,5 C. 7,0 D. 7,5
Đọc tiếp
Cho m gam hỗn hợp M gồm đipeptit X, tripeptit Y, tetrapeptit Z và pentapeptit T (đều mạch hở) tác dụng với dung dịch NaOH vừa đủ thu được hỗn hợp Q gồm muối của Gly, Ala và Val. Đốt cháy hoàn toàn Q bằng một lượng oxi vừa đủ, thu lấy toàn bộ khí và hơi đem hấp thụ vào dung dịch Ca(OH)2 dư thấy khối lượng bình tăng 13,23 (gam) và có 0,84 lit khí thoát ra. Mặt khác, đốt cháy hoàn toàn m gam M, thu được 4,095 gam H2O. Giá trị m gần nhất với?
A.6,0
B. 6,5
C. 7,0
D. 7,5
Chọn A.
Quy đổi hỗn hợp E về 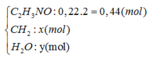
n O 2 = 2 , 25 n C 2 H 3 NO + 1 , 5 n CH 2
→ x =  mol
mol
→ 92,96= 44.( 0,44.2 + 0,66) + 18. ( 1,5.0,44 + 0,66 + y)
→ y = 0,08 =nE
Hỗn hợp E chứa X, Y có tỉ lệ mol tương ứng 1 : 3
→ X : 0,02 mol và Y :0,06 mol
Gọi số mắt xích của X,Y lần lượt là n,m
→ n + m = 10
Và 0,02n + 0,06m= 0,44 → n =4 và m = 6
Gọi số C trong X và Y lần lượt là x1 và y1 ( 8 ≤ x1 ≤ 20, 12≤ y1 ≤ 30)
→ x1.0,02 + y1.0,06 = 0,44. 2 + 0,66
→ x1 + 3y1 = 77
luôn có 6.2 = 12 ≤ y1 ≤ 77 /3 = 25,5
Lập bảng chọn giá trị
x1 = 14(2Gly-2Val) và y1 = 21 (3Gly-3Val)
Vậy thủy phân Y thu được 3 Gly và 3 Val.
Đúng 0
Bình luận (0)