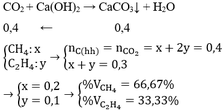Đốt cháy hoàn toàn 3.36l hỗn hợp khí metan và etilen thu toàn bộ sản phẩm qua dung dịch Ca(OH)2 dư hu được 20g chất rắn .tính thành phần % các khí trong hỗn hợp

Những câu hỏi liên quan
đốt cháy hoàn toàn 1.68l hỗn hợp khí A gồm metan và etilen (đktc) nếu cho toàn bộ sản phẩm vào dd ca(oh) dư thu đc 10g kết tủa. tính thành phần % và khối lượng mỗi khí trong hỗn hợp
\(n_{hh}=\dfrac{V_{hh}}{22,4}=\dfrac{1,68}{22,4}=0,075mol\)
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=x\\n_{C_2H_4}=y\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}n_{CO_2\left(CH_4\right)}=x\\n_{CO_2\left(C_2H_4\right)}=2y\end{matrix}\right.\)
\(n_{CaCO_3}=\dfrac{m_{CaCO_3}}{M_{CaCO_3}}=\dfrac{10}{100}=0,1mol\)
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
x+2y x+2y ( mol )
Ta có:
\(\left\{{}\begin{matrix}22,4x+22,4y=1,68\\x+2y=0,1\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,05\\y=0,025\end{matrix}\right.\)
\(\%CH_4=\dfrac{0,05}{0,075}.100=66,66\%\)
\(\%C_2H_4=100\%-66,66\%=33,34\%\)
\(m_{CH_4}=0,05.16=0,8g\)
\(m_{C_2H_4}=0,025.28=0,7g\)
Đúng 2
Bình luận (2)
Đốt cháy hoàn toàn 0,3 mol hỗn hợp metan và etilen. Lấy toàn bộ lượng khí CO2 sinh ra cho vào dung dịch Ca(OH)2 dư thu được 40 gam kết tủa. Tính phần trăm về thể tích mỗi khí trong hỗn hợp ban đầu (các khí trên đo ở cùng điều kiện).
1)cho 4.48 lít khí metan và etilen ở dktc đốt cháy hoàn toàn ; sản phẩm cháy cho lội qua bình đựng nước vôi trong dư thấy tạo thành 70 g chất rắn .tính thành phần phần trăm về khối lượng và thành phần phần trăm về thể tích mỗi khí trong hỗn hợp tạp chất ban đầu2) đốt cháy hoàn toàn 4.48 lít hỗn hợp khí metan và butilen ; sản phẩm cháy cho lội qua bình đựng nước vôi trong dư thấy tạo thành 130g chất rắn a, hỏi cần đốt cháy hết lượng butilen nói trên thì thể tích khí O2 ở ddktc là bao nhiêub, nếu...
Đọc tiếp
1)cho 4.48 lít khí metan và etilen ở dktc đốt cháy hoàn toàn ; sản phẩm cháy cho lội qua bình đựng nước vôi trong dư thấy tạo thành 70 g chất rắn .tính thành phần phần trăm về khối lượng và thành phần phần trăm về thể tích mỗi khí trong hỗn hợp tạp chất ban đầu
2) đốt cháy hoàn toàn 4.48 lít hỗn hợp khí metan và butilen ; sản phẩm cháy cho lội qua bình đựng nước vôi trong dư thấy tạo thành 130g chất rắn
a, hỏi cần đốt cháy hết lượng butilen nói trên thì thể tích khí O2 ở ddktc là bao nhiêu
b, nếu đem lượng butilen ở trên lội qua bình đựng 2 lít dung dịch nước brom 0.5M sau phản ứng .tính nồng độ mol/lít dung dịch cho rằng thể tích dung dịch ko thay đổi và butilenbromua tan được trong nước
1) nh2=0,2; n CACO3=0,7
pt1: CH4+2O2 ---> CO2+2H2O
x x
pt2: C2H4 +3O2 ----> 2CO2+2H2O
y 2y
pt3: CO2+CA(OH)2 ----> CACO3+H2O
0,7 0,7
ta có hệ pt: x+y=0,2
x+2y=0,7
tự tìm
Đúng 0
Bình luận (0)
b) nbr2=1
pt: C4H6+ 2Br2 -----> C4H6Br4
0,05 0,1 0,05
tỉ lệ: 0,3/1 > 0,1/2 => C4H6 dư
CM C4H6Br2=0,05/8,72
CM C4H6 dư= 0,25/8,72
Đúng 0
Bình luận (0)
A)nh2=8,96/22,4=0,4; nCaCO3=130/100=1,3
pt ở dưới nhé =>nCO2=1,3
ta có hệ pt: x+2y=0,4
x+8y=1,3
=> x=0,1; y=0,15
=>VC4H6=0,3.22,4=6,72 (L)
=>VO2=1,85.22,4=41,44 (L)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Câu 3. Dẫn 13,44 lít hỗn hợp khí etilen và khí metan qua bình đựng dung dịch Br2 dư thấy khối lượng bình tăng 5,6 g.
a) Tính % V mỗi khí trong hỗn hợp đầu
b) Nếu đốt cháy hoàn toàn lượng khí trên rồi dẫn sản phẩm qua bình đựng Ca(OH)2dư thì thu được bao nhiêu gam tủa
a) mtăng = mC2H4
=> \(n_{C_2H_4}=\dfrac{5,6}{28}=0,2\left(mol\right)\)
=> \(\%V_{C_2H_4}=\dfrac{0,2.22,4}{13,44}.100\%=33,33\%\)
\(\%V_{CH_4}=100\%-33,33\%=66,67\%\)
b) \(n_{CH_4}=\dfrac{13,44.66,67\%}{22,4}=0,4\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,4--------------->0,4
C2H4 + 3O2 --to--> 2CO2 + 2H2O
0,2----------------->0,4
Ca(OH)2 + CO2 --> CaCO3 + H2O
0,8----->0,8
=> mCaCO3 = 0,8.100 = 80 (g)
Đúng 5
Bình luận (0)
a.\(m_{tăng}=m_{C_2H_4}=5,6g\)
\(n_{hh}=\dfrac{13,44}{22,4}=0,6mol\)
\(n_{C_2H_4}=\dfrac{5,6}{28}=0,2mol\)
\(\%V_{C_2H_4}=\dfrac{0,2}{0,6}.100=33,33\%\)
\(\%V_{CH_4}=100\%-33,33\%=66,67\%\)
b.\(C_2H_4+3O_2\rightarrow\left(t^o\right)2CO_2+2H_2O\)
0,2 0,4 ( mol )
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
0,4 0,4 ( mol )
\(n_{CO_2}=0,4+0,4=0,8mol\)
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
0,8 0,8 ( mol )
\(m_{CaCO_3}=0,8.100=80g\)
Đúng 2
Bình luận (0)
Đốt cháy 4,48 lít hỗn hợp khí CH4 và SiH4 ở đktc thu được m gam chất rắn và sản phẩm khí và hơi. Dẫn toàn bộ sản phẩm khí vào dung dịch Ca(OH)2 dư thấy khối lượng dung dịch tăng 1,6 gam so với khối lượng dung dịch ban đầu. Thành phần phần trăm khối lượng của SiH4 trong hỗn hợp là: A. 50% B. 66,67% C. 33,33% D. 26,7%
Đọc tiếp
Đốt cháy 4,48 lít hỗn hợp khí CH4 và SiH4 ở đktc thu được m gam chất rắn và sản phẩm khí và hơi. Dẫn toàn bộ sản phẩm khí vào dung dịch Ca(OH)2 dư thấy khối lượng dung dịch tăng 1,6 gam so với khối lượng dung dịch ban đầu. Thành phần phần trăm khối lượng của SiH4 trong hỗn hợp là:
A. 50%
B. 66,67%
C. 33,33%
D. 26,7%
cho 9,48 lít khí metan và etilen đốt cháy hoàn toàn sản phẩm cháy cho lội qua bình đựng nước vôi trong dư thấy tạo thành 70 gam chất rắn .tính thành phần phần trăm về thể tích mỗi khí trong hỗn hợp ban đầu
Đốt cháy hoàn toàn 4,481 khí metan trong không khí. dẫn toàn bộ sản phẩm cháy qua bình đựng dung dịch Ca(OH)2 dư thu được x gam chất rắn .
a) Lập phương trình hóa học
b) Tính thể tích không khí cần dùng
\(n_{CH_4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,2 0,4 0,2
CO2 + Ca(OH)2 ---> CaCO3 + H2O
0,2 0,2
\(\rightarrow\left\{{}\begin{matrix}x=0,2.100=20\left(g\right)\\V_{kk}=0,4.5.22,4=44,8\left(l\right)\end{matrix}\right.\)
Đúng 6
Bình luận (0)
Bài 3: Đốt cháy hết 11,2 lít (đktc) hỗn hợp gồm Metan và Axetilen, cho sản phẩm qua dung dịch Ca(OH)2 dư thu được 80g kết tủa. Tính thành phần phần trăm thể tích mỗi chất khí trong hỗn hợp ban đầu.
\(n_{hh}=\dfrac{11,2}{22,4}=0,5mol\)
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=x\\n_{C_2H_2}=y\end{matrix}\right.\)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
x x ( mol )
\(2C_2H_2+5O_2\rightarrow\left(t^o\right)4CO_2+2H_2O\)
y 2y ( mol )
\(n_{CaCO_3}=\dfrac{80}{100}=0,8mol\)
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
0,8 0,8 ( mol )
Ta có:
\(\left\{{}\begin{matrix}x+y=0,5\\x+2y=0,8\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,3\end{matrix}\right.\)
\(\%V_{CH_4}=\dfrac{0,2}{0,5}.100=40\%\)
\(\%V_{C_2H_2}=100\%-40\%=60\%\)
Đúng 2
Bình luận (0)
Gọi a (mol) và b (mol) lần lượt là số mol của khí metan (CH4) và khí axetilen (C2H2).
Giả thiết: a+b=11,2/22,4=0,5 (1).
Số mol kết tủa CaCO3 là 80/100=0,8 (mol) bằng số mol sản phẩm khí CO2 (do dung dịch Ca(OH)2 dư).
Ta có: a+2b=0,8 (2).
Giải hệ phương trình gồm (1) và (2), ta suy ra a=0,2 (mol) và b=0,3 (mol).
Thành phần phần trăm thể tích mỗi chất khí trong hỗn hợp ban đầu:
%Vmetan=0,2/0,5.100%=40%, suy ra %Vaxetilen=100%-40%=60%.
Đúng 0
Bình luận (0)
Hỗn hợp khí X gồm etilen, metan, propin và vynylaxetilen có tỉ khối so với hidro là 17. Đốt cháy hoàn toàn 0,05 mol hỗn hợp X rồi hấp thụ toàn bộ sản phẩm cháy vào bình dung dịch Ca(OH)2 (dư) thì khối lượng bình tăng thêm m gam. Giá trị m là? A. 6,6 B. 7,3 C. 0,85 D. 3,39
Đọc tiếp
Hỗn hợp khí X gồm etilen, metan, propin và vynylaxetilen có tỉ khối so với hidro là 17. Đốt cháy hoàn toàn 0,05 mol hỗn hợp X rồi hấp thụ toàn bộ sản phẩm cháy vào bình dung dịch Ca(OH)2 (dư) thì khối lượng bình tăng thêm m gam. Giá trị m là?
A. 6,6
B. 7,3
C. 0,85
D. 3,39