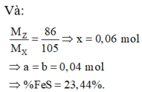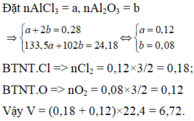đốt cháy 36g FeS2 với 13.44j O2 ở đktc. sau ứ thu được 28g hỗn hợp rắn X và V lít khí Y

Những câu hỏi liên quan
Đốt cháy 36g FeS2 với 13,44 lít khí O2 (đktc). Sau phản ứng thu được 28g hỗn hợp rắn X và V lít hỗn hợp khí Y. Tính hiệu suất phản ứng và thành phần % thể tích các khí trong Y ( các khí được đo cùng điều kiện)
$n_{FeS_2} = \dfrac{36}{120} = 0,3(mol)$
$n_{O_2} = \dfrac{13,44}{22,4} = 0,6(mol)$
$4FeS_2 + 11O_2 \xrightarrow{t^o} 2Fe_2O_3 + 8SO_2$
Vì \(\dfrac{n_{FeS_2}}{4} = 0,075 > \dfrac{n_{O_2}}{11} = 0,0545\) nên $FeS_2$ dư
Gọi hiệu suất là a
\(n_{O_2\ pư} = 0,6a(mol)\\ n_{FeS_2} = \dfrac{4}{11}n_{O_2\ pư} = \dfrac{12a}{55}(mol)\\ n_{Fe_2O_3} = \dfrac{2}{11}n_{O_2\ pư} = \dfrac{6a}{55}(mol)\)
Suy ra :
120.(0,3 - 12a/55 )+ 160.6a/55 = 28
Suy ra a = 0,9167 = 91,67%
Sau phản ứng , khí gồm :
O2 dư : 0,6 - 0,6a = 0,05(mol)
SO2 : 0,4(mol)
Suy ra :
%V O2 = 0,05/(0,05 + 0,4) .100% = 11,11%
%V SO2 = 100% - 11,11% = 88,89%
Đúng 3
Bình luận (1)
Hỗn hợp rắn A gồm FeS2, Cu2S và FeCO3 có khối lượng 20,48 gam. Đốt cháy hỗn hợp A một thời gian bằng oxi thu được hỗn hợp rắn B và 2,24 lít (đktc) hỗn hợp khí X ( không có O2 dư). Toàn bộ B hòa tan trong dung dịch HNO3 đặc, nóng, dư. Kết thúc phản ứng thu được 13,44 lít (đktc) hỗn hợp khí Z gồm 2 khí (không có khí SO2) và dung dịch Y. Cho Ba(OH)2 dư vào dung dịch Y thu được 34,66 gam kết tủa. Lấy kết tủa nung ngoài không khí đến khối lượng không đổi thu được 29,98 gam rắn khan. Biết rằng tỉ khối...
Đọc tiếp
Hỗn hợp rắn A gồm FeS2, Cu2S và FeCO3 có khối lượng 20,48 gam. Đốt cháy hỗn hợp A một thời gian bằng oxi thu được hỗn hợp rắn B và 2,24 lít (đktc) hỗn hợp khí X ( không có O2 dư). Toàn bộ B hòa tan trong dung dịch HNO3 đặc, nóng, dư. Kết thúc phản ứng thu được 13,44 lít (đktc) hỗn hợp khí Z gồm 2 khí (không có khí SO2) và dung dịch Y. Cho Ba(OH)2 dư vào dung dịch Y thu được 34,66 gam kết tủa. Lấy kết tủa nung ngoài không khí đến khối lượng không đổi thu được 29,98 gam rắn khan. Biết rằng tỉ khối của Z so với X bằng 86/105. Phần trăm khối lượng FeS2 trong A gần với giá trị
A. 17,58%.
B. 23,44%.
C. 29,30%.
D. 35,16%.
X là một peptit có 16 mắt xích (cấu tạo từ Gly, Ala, Val). Đốt cháy m gam X cần dùng 45,696 lít O2 Lấy m gam X cho tác dụng vừa đủ với dung dịch NaOH, cô cạn thu được hỗn hợp chất rắn Y. Đốt cháy hoàn toàn Y trong bình chứa 12,5 mol không khí thu được chất rắn, hơi và 271,936 lít hỗn hợp khí Z. Thể tích các khí đo ở đktc, trong không khí có 20% thể tích O2 còn lại là N2. Giá trị của m gần nhất với giá trị nào sau đây? A. 46 gam B. 41 gam C. 43 gam D. 38 gam.
Đọc tiếp
X là một peptit có 16 mắt xích (cấu tạo từ Gly, Ala, Val). Đốt cháy m gam X cần dùng 45,696 lít O2 Lấy m gam X cho tác dụng vừa đủ với dung dịch NaOH, cô cạn thu được hỗn hợp chất rắn Y. Đốt cháy hoàn toàn Y trong bình chứa 12,5 mol không khí thu được chất rắn, hơi và 271,936 lít hỗn hợp khí Z. Thể tích các khí đo ở đktc, trong không khí có 20% thể tích O2 còn lại là N2. Giá trị của m gần nhất với giá trị nào sau đây?
A. 46 gam
B. 41 gam
C. 43 gam
D. 38 gam.
P là hỗn hợp gồm ba hợp chất hữu cơ X, Y, Z đồng phân của nhau và đều tác dụng được với NaOH. Khi hóa hơi 3,7 gam X thu được 1,68 lít khí ở 136,5oC, 1atm. Mặt khác, dùng 2,52 lít (đktc) O2 để đốt cháy hoàn toàn 1,665 gam P sau phản ứng thu được V lít hỗn hợp khí (đktc). Giá trị V là A. 3,024 B. 1,512 C. 2,240 D. 2,268
Đọc tiếp
P là hỗn hợp gồm ba hợp chất hữu cơ X, Y, Z đồng phân của nhau và đều tác dụng được với NaOH. Khi hóa hơi 3,7 gam X thu được 1,68 lít khí ở 136,5oC, 1atm. Mặt khác, dùng 2,52 lít (đktc) O2 để đốt cháy hoàn toàn 1,665 gam P sau phản ứng thu được V lít hỗn hợp khí (đktc). Giá trị V là
A. 3,024
B. 1,512
C. 2,240
D. 2,268
Đáp án D

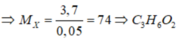
Khi đốt P
n
P
=
0
,
025
⇒
n
C
O
2
=
n
H
2
O
=
0
,
0675
⇒ n O 2 = 0 , 0675 . 3 - 0 , 0225 . 22 = 0 , 07875
Thể tích khí còn lại sau phản ứng:
V
=
n
C
O
2
+
n
O
2
d
u
=
2
,
268
Đúng 0
Bình luận (0)
P là hỗn hợp gồm ba hợp chất hữu cơ X, Y, Z đồng phân của nhau và đều tác dụng được với NaOH. Khi hóa hơi 3,7 gam X thu được 1,68 lít khí ở 136,5oC, 1atm. Mặt khác, dùng 2,52 lít (đktc) O2 để đốt cháy hoàn toàn 1,665 gam P sau phản ứng thu được V lít hỗn hợp khí (đktc). Giá trị V là A. 3,024 B. 1,512 C. 2,240 D. 2,268
Đọc tiếp
P là hỗn hợp gồm ba hợp chất hữu cơ X, Y, Z đồng phân của nhau và đều tác dụng được với NaOH. Khi hóa hơi 3,7 gam X thu được 1,68 lít khí ở 136,5oC, 1atm. Mặt khác, dùng 2,52 lít (đktc) O2 để đốt cháy hoàn toàn 1,665 gam P sau phản ứng thu được V lít hỗn hợp khí (đktc). Giá trị V là
A. 3,024
B. 1,512
C. 2,240
D. 2,268
Đáp án: D
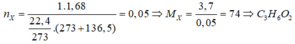
Khi đốt P
n
P
=
0
,
0225
⇒
n
C
O
2
=
n
H
2
O
=
0
,
0675
⇒
n
C
O
2
=
0
,
07875
Thể tích khí còn lại sau phản ứng:
V = n C O 2 + n O 2 d u , = 2 , 268
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 44,8 gam hỗn hợp gồm FeS và FeS2 trong V lít không khí (đktc) vừa đủ (không khí có 20% thể tích là O2, 80% thể tích là N2), thu được m gam Fe2O3 và V’ lít hỗn hợp khí (đktc) gồm N2 và SO2, trong đó SO2 chiếm 14,89% về thể tích.a/ Viết PTHH.b/ Tìm V.c/ Tính khối lượng từng chất trong hỗn hợp đầu.d/ Tìm m.
Đọc tiếp
Đốt cháy hoàn toàn 44,8 gam hỗn hợp gồm FeS và FeS2 trong V lít không khí (đktc) vừa đủ (không khí có 20% thể tích là O2, 80% thể tích là N2), thu được m gam Fe2O3 và V’ lít hỗn hợp khí (đktc) gồm N2 và SO2, trong đó SO2 chiếm 14,89% về thể tích.
a/ Viết PTHH.
b/ Tìm V.
c/ Tính khối lượng từng chất trong hỗn hợp đầu.
d/ Tìm m.
Đốt cháy hoàn toàn hỗn hợp FeS và FeS2 cần 13,16 lít oxi, thu được 8,96 lít khí X và chất rắn Y. Dùng hiđro khử hoàn toàn Y thu được m gam chất rắn. Biết thể tích các khí đo ở điều kiện tiêu chuẩn. Giá trị của m là A. 11,2 B. 8,4 C. 5,6 D. 14,0
Đọc tiếp
Đốt cháy hoàn toàn hỗn hợp FeS và FeS2 cần 13,16 lít oxi, thu được 8,96 lít khí X và chất rắn Y. Dùng hiđro khử hoàn toàn Y thu được m gam chất rắn. Biết thể tích các khí đo ở điều kiện tiêu chuẩn. Giá trị của m là
A. 11,2
B. 8,4
C. 5,6
D. 14,0
Chọn đáp án D
nO2 phản ứng = 0,5875 mà nSO2 (X) tạo thành = 0,4 Þ nO trong Y = 0,5875x2 - 0,4x2 = 0,375
Þ nFe2O3 = 0,375/3 = 0,125 Þ nFe thu được sau khi khử Y = 0,125x2 = 0,25
Vậy m = 0,25x56 = 14.
Đúng 0
Bình luận (0)
Đốt cháy m gam Al trong x lít oxi thu được hỗn hợp rắn. Cho hỗn hợp rắn qua V lít dung dịch HCl 1M (đủ) thu được 13,35g muối và 1,68 lít H2. Các thể tích khí đo ở đktc. Tính m, x, V.
- Vì hỗn hợp rắn qua dd HCl có thấy H2 nên hh rắn chắc chắn có Al dư
\(PTHH:\left(a\right)4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ \left(b\right)Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\\ \left(c\right)2Al_{dư}+6HCl\rightarrow2AlCl_3+3H_2\\ n_{H_2\left(c\right)}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\\ n_{AlCl_3\left(tổng\right)}=\dfrac{13,35}{133,5}=0,1\left(mol\right)\\ n_{AlCl_3\left(c\right)}=n_{Al\left(dư\right)}=\dfrac{2}{3}.n_{H_2\left(c\right)}=\dfrac{2.0,075}{3}=0,05\left(mol\right)\\ \Rightarrow n_{AlCl_3\left(b\right)}=0,1-0,05=0,05\left(mol\right)\\ \Rightarrow n_{HCl}=\dfrac{6}{2}.n_{AlCl_3\left(tổng\right)}=\dfrac{6}{2}.0,1=0,3\left(mol\right)\\ \Rightarrow V=V_{ddHCl}=\dfrac{0,3}{1}=0,3\left(l\right)\\ n_{Al_2O_3}=\dfrac{n_{AlCl_3\left(b\right)}}{2}=\dfrac{0,05}{2}=0,025\left(mol\right)\)
\(\Rightarrow n_{Al\left(a\right)}=2.n_{Al_2O_3}=2.0,025=0,05\left(mol\right)\\ \Rightarrow n_{Al\left(tổng\right)}=n_{Al\left(a\right)}+n_{Al\left(c\right)}=0,05+0,05=0,1\left(mol\right)\\ \Rightarrow m=m_{Al\left(tổng\right)}=0,1.27=2,7\left(g\right)\\ n_{O_2}=\dfrac{3}{2}.n_{Al_2O_3}=\dfrac{3}{2}.0,025=0,0375\left(mol\right)\\ \Rightarrow V=V_{O_2\left(đktc\right)}=0,0375.22,4=0,84\left(l\right)\)
Đúng 4
Bình luận (0)
Đốt cháy hoàn toàn 7,56 gam bột nhôm cần dùng V lít (đktc) hỗn hợp khí gồm O2 và Cl2, thu được 24,18 gam hỗn hợp rắn X gồm AlCl3 và Al2O3 (không có khí thoát ra). Giá trị của V là A. 6,272 lít B. 5,376 lít C. 7,168 lít D. 6,720 lít
Đọc tiếp
Đốt cháy hoàn toàn 7,56 gam bột nhôm cần dùng V lít (đktc) hỗn hợp khí gồm O2 và Cl2, thu được 24,18 gam hỗn hợp rắn X gồm AlCl3 và Al2O3 (không có khí thoát ra). Giá trị của V là
A. 6,272 lít
B. 5,376 lít
C. 7,168 lít
D. 6,720 lít