khí a có công thức chung là RO2 bt tỉ khối của áo vs kk là 1,5862 hãy xác định công thức của khí a
a) Hợp chất A có công thức là : R2O3. Biết 0,25 mol hợp chất A có khối là 40g. Hãy xác định công thức hóa học của A
b) Khí A có công thức dạng RO2. Biết dA/kk = 1,5862. Hãy xác dịnh công thức của khí A
a)
$M_A = 2R + 16.3 = \dfrac{40}{0,25} = 160(đvC)$
$\Rightarow R = 56(Fe)$
Vậy CTHH của A là $Fe_2O_3$
b)
$M_A = R + 16.2 = 1,5862.29 = 46(đvC)$
$\Rightarrow R = 14(N)$
Vậy khí A là $N_2$
Khí A có công thức dạng chung là :RO2.Biết dA/KK = 1,5173.
a) Xác định khối lượng mol của khí A.
b) Hãy xác định công thức hóa học của khí A.
a/ Vì dA/KK = 1,5173
=> MA = 1,5173 x 29 = 44 (g/mol)
b/ MA = 44 = MR + 16 x 2
=> MR = 44 - 32 = 12(g/mol)
=> R là cacbon
=> Công thức khí A: CO2
a.ta có dA/kk=1,5173
->MA=dA/kk.29=1,5173.29=44g/mol
b.
ta có MA=44g/mol
->R+2O=44
R+32=44R=12g/molvậy R LÀ C (Cacbon )CTHH CO2Câu 28: Nêu được 2 hiện tượng thực tế liên quan đến sự nhiễm điện do cọ xát. Giải thích
Câu 29: Khí A có công thức dạng RO2. Biết dA/kk = 1,5862. Hãy xác định công thức của khí A?
Câu 30
a) Liệt kê 2 nguồn điện thông dụng trong đời sống.
b) Liệt kê được 2 vật liệu đẫn điện, 2 vật liệu cách điện.
c) 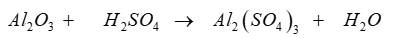
Hợp chất B ở thể khí có công thức là RO2. Biết rằng khối lượng của 6,1975 lít khí B ở điều kiện 25o là 16g. Hãy xác định công thức của B
Câu 27: Tỉ khối của khí A đối với không khí là dA/KK < 1. Là khí nào trong các khí sau:
A. O2 B.H2S C. CO2 D. N2
Câu 28: Oxit có công thức hoá học RO2, trong đó mỗi nguyên tố chiếm 50% khối lượng. Khối lượng của R trong 1 mol oxit là:
A. 16g B. 32g C. 48g D.64g
Câu 27: Tỉ khối của khí A đối với không khí là dA/KK < 1. Là khí nào trong các khí sau:
A. O2 B.H2S C. CO2 D. N2
Câu 28: Oxit có công thức hoá học RO2, trong đó mỗi nguyên tố chiếm 50% khối lượng. Khối lượng của R trong 1 mol oxit là:
A. 16g B. 32g C. 48g D.64g
Hai chất khi A, B có công thức dạng chung lần lượt là XY2 và X2Y . Nếu trộn hai khí A, B theo tỉ lệ số mol là 2:3 thì đc 1 hỗn hợp khí C có tỉ khối so vs khí hidro là 22,4. Mặt khác , tỉ khối A so với B xấp xỉ bằng 1,0455.
a) xác định công thức hóa học của A và B.
b) Tính khối lượng nguyên tố Y có trong 25,3 gam mỗi chất A,B nói trên.
c) Để thu mỗi khí A,B vào lọ bằng phương pháp đẩy không khí thì thực hiện đặt ngược hay đặt đứng lọ ? Vì sao?
Làm hộ em với ạ!!!!!
(つ≧▽≦)つ
a) Giả sử có 2 mol A, 3 mol B
=> \(\dfrac{2.M_A+3.M_B}{2+3}=22,4.2=44,8\)
=> 2.MA + 3.MB = 224
Mà \(\dfrac{M_A}{M_B}=1,0455\)
=> MA = 46, MB = 44
=> \(\left\{{}\begin{matrix}M_X+2M_Y=46\\2M_X+M_y=44\end{matrix}\right.=>\left\{{}\begin{matrix}M_X=14\\M_Y=16\end{matrix}\right.\) => X là N, Y là O
CTHH của A là NO2, của B là N2O
b)- \(n_{NO_2}=\dfrac{25,3}{46}=0,55\left(mol\right)=>n_O=0,55.2=1,1\left(mol\right)\)
=> \(m_O=1,1.16=17,6\left(g\right)\)
- \(n_{N_2O}=\dfrac{25,3}{44}=0,575\left(mol\right)=>n_O=0,575\left(mol\right)\)
=> mO = 0,575.16 = 9,2(g)
c) \(d_{NO_2/kk}=\dfrac{46}{29}=1,586\)
=> NO2 nặng hơn kk nên đặt đứng lọ
\(d_{N_2O/kk}=\dfrac{44}{29}=1,517\)
=> N2O nặng hơn kk nên đặt đứng lọ
Hai chất khí A, B có công thức dạng chung lần lượt là XY2, X2Y nếu trộn 2 khí A, B theo tỉ lệ số mol 2:3 thì được một hỗn hợp khí C có tỉ khối so với khí hidro là 22,4. Mặt khác tỉ khối của A so với B xấp xỉ bằng 1,0455 a) Xác định công thức hóa học của A và B b) tính khối lượng nguyên tố Y có trong 25,3 g mỗi chất A, B nói trên c) để thu mỗi khí A, B vào lọ bằng phương pháp đẩy không khí thì thực hiện đặt ngược hay đứng lọ? Vì sao?
Khí A có công thức chung là RH3, khí A nhẹ hơn và chỉ bằng 0,53125 lần khí Oxygen. Hãy xác định công thức hoá học của khí A? Giúp Mình với các bạn ơi!
MA=32.0,53125 = 17
RH3 = MR + 3 = 17 --> R = 14 (N)
R là: B=Nitrogen (N)
\(PTK_A=0,53125.32=17\left(đ.v.C\right)=NTK_R+3.1=NTK_R+3\\ \Rightarrow NTK_R=17-3=14\left(đ.v.C\right)\\ \Rightarrow R:Nito\left(N=14\right)\\ \Rightarrow A:NH_3\)
Hợp chất khí có công thức tổng quát là RO2. Biết rằng 8,8 gam hợp chất khí này có thể tích gấp hai lần thể tích của 3,2 gam khí O2 ở cùng điều kiện nhiệt độ và áp suất. Hãy xác định công thức hóa học của hợp chất khí
\(n_{O_2}=\dfrac{3,2}{32}=0,1\left(mol\right)=>n_{RO_2}=0,2\left(mol\right)\)
=> \(M_{RO_2}=\dfrac{8,8}{0,2}=44\left(g/mol\right)\)
=> MR = 12(g/mol)
=> R là C
=> CTHH: CO2