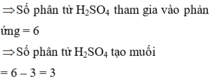Cho Fe tác dụng với a xít H2SO4 đặc ,nóng .Sau phản ứng thu đc Fe2(SO4)3, khí SO2 và nước.Lập phương trình phản ứng

Những câu hỏi liên quan
Cho sơ đồ phản ứng: H2SO4 (đặc, nóng) + Fe - Fe2(SO4)3 + H2O + SO2. Số phân tử H2SO4 bị khử và số phân tử H2SO4 trong phương trình hóa học của phản ứng trên là: A. 3 và 6 B. 3 và 3 C. 6 và 3 D. 6 và 6
Đọc tiếp
Cho sơ đồ phản ứng:
H2SO4 (đặc, nóng) + Fe -> Fe2(SO4)3 + H2O + SO2.
Số phân tử H2SO4 bị khử và số phân tử H2SO4 trong phương trình hóa học của phản ứng trên là:
A. 3 và 6
B. 3 và 3
C. 6 và 3
D. 6 và 6
Chọn B
2Fe + 6H2SO4 -> Fe2(SO4)3 + 3SO2 + 6H2O
Số phân tử bị khử thành SO2 chính bằng số SO2
Đúng 0
Bình luận (0)
Cho sơ đồ phản ứng: H2SO4 (đặc nóng) + Fe ® Fe2(SO4)3 + SO2 +H2O Số phân tử H2SO4 bị khử trong phương trình hoá học của phản ứng trên là A. 2. B. 4. C. 6. D. 3.
Đọc tiếp
Cho sơ đồ phản ứng: H2SO4 (đặc nóng) + Fe ® Fe2(SO4)3 + SO2 +H2O
Số phân tử H2SO4 bị khử trong phương trình hoá học của phản ứng trên là
A. 2.
B. 4.
C. 6.
D. 3.
Đáp án D
Số oxi hoá các nguyên tố thay đổi:
Fe 0 + H 2 S + 6 O 4 ( đặc ) → t ° Fe 2 + 3 ( SO 4 ) 3 + S + 4 O 2 + H 2 O
Số phân tử H2SO4 bị khử chính là số phân tử H2SO4 là chất oxi hoá. H2SO4 là chất oxi hoá khi S + 6 chuyển thành S + 4
Các quá trình nhường, nhận electron:
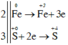
=> Số phân tử H2SO4 bị khử là 3
Đúng 0
Bình luận (0)
1. Cân bằng phương trình hóa học của các phản ứng sau bằng phương pháp thăng bằng electron. Cho biết chất oxi hóa và chất khử của mỗi phản ứng : Fe + H2SO4 đặc,nóng → Fe2 (SO4)3 + SO2 + H2O KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O 2. Tính khối lượng CaF2 cần dùng để điều chế 2,5 kg dung dịch axit Flohidric nồng độ 40%. 3. Hòa tan 11 gam hỗn hợp bột sắt và nhôm trong dung dịch HCl thu được 8,96 lit khí (điều kiện tiêu chuẩn). a. Xác định thành phần phần trăm về khối lượng của mỗi kim loại tron...
Đọc tiếp
1. Cân bằng phương trình hóa học của các phản ứng sau bằng phương pháp thăng bằng electron. Cho biết chất oxi hóa và chất khử của mỗi phản ứng :
Fe + H2SO4 đặc,nóng → Fe2 (SO4)3 + SO2 + H2O
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
2. Tính khối lượng CaF2 cần dùng để điều chế 2,5 kg dung dịch axit Flohidric nồng độ 40%.
3. Hòa tan 11 gam hỗn hợp bột sắt và nhôm trong dung dịch HCl thu được 8,96 lit khí (điều kiện tiêu chuẩn).
a. Xác định thành phần phần trăm về khối lượng của mỗi kim loại trong hỗn hợp. b. Tính thể tích dung dịch HCl 2M đã dùng.
(Cho Ca = 40; F = 19; H =1; Fe = 56; Al = 27)
Bài 2:
\(m_{HF}=\dfrac{2,5.40\%}{100\%}=1(kg)\\ \Rightarrow n_{HF}=\dfrac{1}{20}=0,05(kmol)\\ PTHH:CaF+H_2SO_4\to CaSO_4+2HF\\ \Rightarrow n_{CaF}=0,025(kmol)\\ \Rightarrow m_{CaF}=0,025.78=1,95(kg)\)
Bài 3:
\(a,\) Đặt \(\begin{cases} n_{Fe}=x(mol)\\ n_{Al}=y(mol) \end{cases} \)
\(n_{H_2}=\dfrac{8,96}{22,4}=0,4(mol)\\ PTHH:2Al+6HCl\to 2AlCl_3+3H_2\\ Fe+2HCl\to FeCl_2+H_2\\ \Rightarrow \begin{cases} 56x+27y=11\\ x+1,5y=0,4 \end{cases} \Rightarrow \begin{cases} x=0,1(mol)\\ y=0,2(mol) \end{cases}\\ \Rightarrow \begin{cases} \%_{Fe}=\dfrac{0,1.56}{11}.100\%=50,91\%\\ \%_{Al}=100\%-50,91\%=49,09\% \end{cases} \)
\(b,\Sigma n_{HCl}=3n_{Al}+2n_{Fe}=0,2+0,6=0,7(mol)\\ \Rightarrow V_{dd_{HCl}}=\dfrac{0,7}{2}=0,35(l)\)
Đúng 1
Bình luận (0)
Cho 22,4g Fe tác dụng với dung dịch loãng có chứa 24,5 g H2SO4 sau phản ứng hãy cho biết: a, Chất nào dư sau phản ứng và dư bao nhiêu gam? b, Tính thể tích H2 thu được ở đktc. Có đc ghi fe +h2so4--->fe2(so4)3 +h2 đc ko ạ
`Fe + H_2 SO_4 -> FeSO_4 + H_2`
`0,25` `0,25` `0,25` `(mol)`
`a)n_[Fe]=[22,4]/56=0,4(mol)`
`n_[H_2 SO_4]=[24,5]/98=0,25(mol)`
Có: `[0,4]/1 > [0,25]/1=>Fe` hết, `H_2 SO_4`
`=>m_[Fe(dư)]=(0,4-0,25).56=8,4(g)`
`b)V_[H_2]=0,25.22,4=5,6(l)`
Ko được ghi `Fe+H_2 SO_4->Fe_2 (SO_4)_3+H_2` vì đây là `H_2 SO_4` loãng
Đúng 4
Bình luận (2)
cho 12,8gam hỗn hợp x gồm FeO và Fe vào dunh dịch H2SO4 loãng, dư. Sau khi các phản ứng xảy ra hoàn toàn thì thu đc 2,24 lít khí ở đktc
cho 6,4 gam hỗn hợp x ở trên tác dụng với dung dịch h2so4 đặc nóng , dư thu đc khí so2, sục toàn bộ lượng khí so2 thu đc vào dung dịch nc vôi trong lấy dư thaasyxuaats hiện kết tủa. cho biết lượng dung dịch nc vôi trong tăng hay giảm bao nhiêu gam
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(FeO+H_2SO_4\rightarrow FeSO_4+H_2O\)
\(n_{H_2}=n_{Fe}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
=> \(n_{FeO}=\dfrac{12,8-56.0,1}{72}=0,1\left(mol\right)\)
12,8 g hh X ------> 0,1 mol Fe và 0,1 mol FeO
=> 6,4g hh X ------> 0,05 mol Fe và 0,05 mol FeO
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
2FeO + 4H2SO4 → 4H2O + Fe2(SO4)3 + SO2
=> \(n_{SO_2}=\dfrac{3}{2}n_{Fe}+\dfrac{1}{2}n_{FeO}=0,1\left(mol\right)\)
SO2 + Ca(OH)2→ CaSO3 + H2O
Vì kết tủa nên khối lượng dung dịch giảm : \(m_{thêm}-m_{mất}=0,1.64+0,1.74-0,1.120=1,8\left(g\right)\)
Đúng 1
Bình luận (0)
Fe+ H2SO4 -> FeSO4 + H2
0,1___0,1______0,1__0,1(mol)
FeO+ H2SO4-> FeSO4 + H2O
=>mFe= 0,1.56=5,6(g)
=>%mFe=(5,6/12.8).100=43.75%
=>%mFeO=56,25%
6,4gam hh X => Số mol giảm đi 1/2
nFe=0,05(mol)=nCu
PTHH: 2 Fe + 6 H2SO4(đ)-to-> Fe2(SO4)3 + 3 SO2 + 6 H2O
0,05_______0,15__________0,025________0,075(mol)
Cu+ 2 H2SO4(đ) -to-> CuSO4 + SO2 + H2O
0,05___0,1_________0,05____0,05(mol)
=> nSO2=0,125(mol)
PTHH: SO2 + Ca(OH)2 -> CaSO3 + H2O
0,125_______0,125_____0,125(mol)
=> KL dung dịch giảm.
KL giảm:
0,125.64 + 0,125.74 - 0,125.120=2,25(g)
Chúc em học tốt!
Đúng 1
Bình luận (1)
Trong các sơ đồ phản ứng hóa học sau đây: 1. Fe3O4 + HCl → FeCl2 + FeCl3 + H2O 2. Fe(OH)3 + H2SO4 đặc, nóng → Fe2(SO4)3 + SO2 + H2O 3. FeO + HNO3 loãng → Fe(NO3)3 + NO + H2O 4. FeCl2 + HNO3 loãng → Fe(NO3)3 + HCl + NO + H2O 5. Al + HNO3 loãng → Al(NO3)3 + H2 6. FeO + H2SO4 đặc, nóng → Fe2(SO4)3 + SO2 + H2O Có bao nhiêu phản ứng viết sai? A. 1 B. 2 C. 3 D. 4
Đọc tiếp
Trong các sơ đồ phản ứng hóa học sau đây:
1. Fe3O4 + HCl → FeCl2 + FeCl3 + H2O
2. Fe(OH)3 + H2SO4 đặc, nóng → Fe2(SO4)3 + SO2 + H2O
3. FeO + HNO3 loãng → Fe(NO3)3 + NO + H2O
4. FeCl2 + HNO3 loãng → Fe(NO3)3 + HCl + NO + H2O
5. Al + HNO3 loãng → Al(NO3)3 + H2
6. FeO + H2SO4 đặc, nóng → Fe2(SO4)3 + SO2 + H2O
Có bao nhiêu phản ứng viết sai?
A. 1
B. 2
C. 3
D. 4
Cho Fe tác dụng hết với dung dịch H2SO4 đặc nóng thu được khí SO2 ( sản phẩm khử duy nhất) và 8,28 gam muối. Biết số mol Fe bằng 37,5% số mol H2SO4 phản ứng. Khối lượng Fe đã tham gia phản ứng là A. 2,52 gam B. 1,68 gam C. 1,12 gam D. 1,08 gam.
Đọc tiếp
Cho Fe tác dụng hết với dung dịch H2SO4 đặc nóng thu được khí SO2 ( sản phẩm khử duy nhất) và 8,28 gam muối. Biết số mol Fe bằng 37,5% số mol H2SO4 phản ứng. Khối lượng Fe đã tham gia phản ứng là
A. 2,52 gam
B. 1,68 gam
C. 1,12 gam
D. 1,08 gam.
2 Fe + 2n H2SO4 --> Fe2(SO4)n + n SO2 + n H2O
a------------an-----------0,5a
số mol Fe bằng 37,5% => a = 0,375*na => n = 2,667 khối lượng muối = 0,5a(56+96n) = 8,28 => a = 0,045 khối lượng Fe = 56*0,045 = 2,52
=> Đáp án A
Đúng 0
Bình luận (0)
Cho sơ đồ phản ứng:
Fe
+
H
2
SO
4
đặc/nóng
→
Fe
2
(
SO
4
)
3
+
SO
2
+
H
2
O
Số phân tử
H
2
SO
4
bị khử và số phân tử ...
Đọc tiếp
Cho sơ đồ phản ứng:
Fe + H 2 SO 4 đặc/nóng → Fe 2 ( SO 4 ) 3 + SO 2 + H 2 O
Số phân tử H 2 SO 4 bị khử và số phân tử H 2 SO 4 tạo muối là
A. 6 và 3.
B. 3 và 6.
C. 6 và 6.
D. 3 và 3.
Khi cho sắt tác dụng với
H
2
S
O
4
H đặc nóng thì ta thu được muối sắt (III) sunfat, khí
S
O
2
và
H
2
O
. Phương trình phản ứng thể hiện quá trình trên là: A.
2
F
e
+
4
H
2...
Đọc tiếp
Khi cho sắt tác dụng với H 2 S O 4 H đặc nóng thì ta thu được muối sắt (III) sunfat, khí S O 2 và H 2 O . Phương trình phản ứng thể hiện quá trình trên là:
A. 2 F e + 4 H 2 S O 4 đ ặ c → F e 2 S O 4 3 + S O 2 + H 2 O
B. 2 F e + 6 H 2 S O 4 đ ặ c → F e 2 S O 4 3 + 3 S O 2 + H 2 O
C. 4 F e + 3 H 2 S O 4 đ ặ c → F e 2 S O 4 3 + 5 S O 2 + H 2 O
D. 2 F e + 6 H 2 S O 4 đ ặ c → F e 2 S O 4 3 + 3 S O 2 + 6 H 2 O
Cho 36,8 gam hỗn hợp Z gồm Fe và FeO tác dụng với dung dịch H2SO4 đặc nóng, dư. Sau phản ứng thu được 15,68 lít khí SO2 (đktc). Khối lượng muối thu được trong dung dịch sau phản ứng là bao nhiêu?
A. 120 gam.
B. 12 gam.
C. 24 gam.
D. 60 gam.
Gọi $n_{Fe} = a(mol) ; n_{FeO} = b(mol) \Rightarrow 56a + 72b = 36,8(1)$
$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$
$2FeO + 4H_2SO_4 \to Fe_2(SO_4)_3 + SO_2 + 4H_2O$
Theo PTHH :
$n_{SO_2} = 1,5a + 0,5b = 15,68 : 22,4 = 0,7(2)$
Từ (1)(2) suy ra a = 0,4 ; b = 0,2
$n_{Fe_2(SO_4)_3} = (a + b).0,5 = 0,3(mol)$
$m_{Fe_2(SO_4)_3} = 0,3.400 = 120(gam)$
Đúng 3
Bình luận (0)