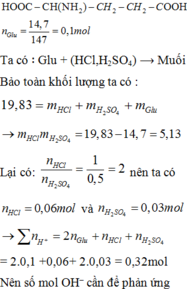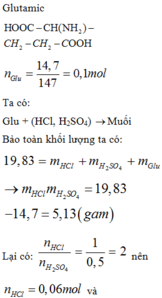Câu 1: a.Cần lấy bao nhiêu gam bari hiđroxit cho vào dung dịch có chứa 39,2g axit photphoric để thu được 46,6 gam Bari hiđrophotphat và 60,1gam bải photphat.
b. Tính thể tích dung dịch AgNO3 0,5M cần để kết tủa hết ion PO4(3-) trong dung dịch axit ban đầu.
Câu 2: a.Cần lấy bao nhiêu gam NaOH cho vào dd có chứa 5,88g acid phosphoric để thu. được 2,84g natri hidrophoshpat và 6,56g natriphosphat?
b. Tính thế tích dung dịch AgNO3 2M cần dùng để kết tủa hết ion photphat có trong dung dịch muối trine.
Câu 3: Hỗn hợp A gồm 2 khi N2 và H2 được trộn theo tỉ lệ mol 1:4 được cho veo bình kín. Nung A với xcc tác được hỗn hợp B, sau đó đưa về nhiệt độ ban đầu thấy áp suất trong bình giảm 10% so với áp suât lac đầu. Tính hiệu suất của phản ứng tổng hợp NH3.
Câu 4: Cho 19,1 gam hỗn hợp gồm Mg, Al, Zn tác dụng vừa đủ với 1740ml dung dịch HNO3 1M the được dung dịch chứa m gam muối và 2,688 lít hỗn hợp khí X gồm N2 và N2O (đktc), tỉ khối của hỗn hợp X so với H2 là 20,677. Tìm m.
Câu 5: Hỗn hợp X gồm Mg và Al. Cho 5,22 gam X tan hết trong dung dịch HNO3 loãng dư thu được 3,584 lít khi NO (sản phẩm khử duy nhất, ở đktc) và dung dịch A.
a) Tính % khối lượng mỗi kim loại trong hỗn hợp.
b) Cô cạn dung dịch A, rồi lấy chất rắn the được đem sung tới khối lượng không đổi ta có hỗn hợp khí B. Cho toàn bộ hỗn hợp khí B hấp thụ hết vào 500ml H2O. Tìm pH của dung dịch thu được.

Những câu hỏi liên quan
Cặp chất nào sau đây có thể tồn tại trong cùng một dung dịch ?
A. axit nitric và đồng(II) nitrat
B. đồng (II) nitrat và amoniac
C. bari hiđroxit và axit photphoric.
D. amoni hiđrophotphat và kali hiđroxit
1)Cho dung dịch chứa 34,2g bari hiđroxit vào dung dịch chứa 18,25g axit clohiđric, dung dịch sau phản ứng có (cho Ba137; O16; H1; Cl35,5)A. pH 7.B. pH 7.C. pH 7.D. pH 9.2)Cho 1,5 gam hỗn hợp (X) gồm Mg và MgO tác dụng với axit HCl dư, thu được 0,336 lít khí hiđro (đktc). Thành phần phầm trăm của mỗi chất trong (X) là: (Cho Mg24; O16; H1; Cl35,5.)A. 50% Mg và 50% MgOB. 25% Mg và 75% MgOC. 24% Mg và 76% MgOD. 30% Mg và 70% MgO3)Dãy các kim loại nào sau đây được sắp xếp đúng theo chiều hoạt độn...
Đọc tiếp
1)Cho dung dịch chứa 34,2g bari hiđroxit vào dung dịch chứa 18,25g axit clohiđric, dung dịch sau phản ứng có (cho Ba=137; O=16; H=1; Cl=35,5)
A. pH > 7.
B. pH < 7.
C. pH = 7.
D. pH > 9.
2)Cho 1,5 gam hỗn hợp (X) gồm Mg và MgO tác dụng với axit HCl dư, thu được 0,336 lít khí hiđro (đktc). Thành phần phầm trăm của mỗi chất trong (X) là: (Cho Mg=24; O=16; H=1; Cl=35,5.)
A. 50% Mg và 50% MgO
B. 25% Mg và 75% MgO
C. 24% Mg và 76% MgO
D. 30% Mg và 70% MgO
3)
Dãy các kim loại nào sau đây được sắp xếp đúng theo chiều hoạt động hóa học tăng dần?
A. Cu, Fe, Zn, Al, Mg, K.
B. Fe, Cu, K, Mg, Al, Zn.
C. K, Mg, Cu, Al, Zn, Fe.
D. Zn, K, Mg, Cu, Al, Fe.
Trung hòa hoàn toàn 100 gam dung dịch axit sunfuric 24,5% bằng dung dịch bari hiđroxit thu được bao nhiêu gam kết tủa?
A. 24,5 gam.
B. 100 gam.
C. 57 gam.
D. 58,25 gam.
\(H_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4+2H_2O\)
\(n_{BaSO_4}=n_{H_2SO_4}=\dfrac{100.24,5\%}{98}=0,25\left(mol\right)\)
=> \(m_{BaSO_4}=0,25.233=58,25\left(g\right)\)
=> Chọn D
Đúng 2
Bình luận (0)
Khối lượng của axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{24,5.100}{100}=24,5\left(g\right)\)
Số mol của axit sunfuric
nH2SO4 = \(\dfrac{m_{HSO4}}{M_{H2SO4}}=\dfrac{24,5}{98}=0,25\left(mol\right)\)
Pt : Ba(OH)2 + H2SO4 → BaSO4 + 2H2O\(|\)
1 1 1 2
0,25 0,25
Số mol của bari sunfat
nBaSO4 = \(\dfrac{0,25.1}{1}=0,25\left(mol\right)\)
Khối lượng của bari sunfat
mBaSO4 = nBaSO4 . MBaSO4
= 0,25. 233
= 58,25 (g)
⇒ Chọn câu : D
Chúc bạn học tốt
Đúng 1
Bình luận (0)
Xem thêm câu trả lời
Cho 14,7 gam axit glutamic vào dung dịch H2SO4 0,5M và HCl 1M, thu được dung dịch X chứa 19,83 gam chất tan. Thể tích dung dịch NaOH 1M và KOH 0,6M cần lấy để phản ứng vừa đủ với chất tan trong dung dịch X là: A. 160,0 ml B. 225,0 ml C. . 180,0 ml D. 200,0 ml
Đọc tiếp
Cho 14,7 gam axit glutamic vào dung dịch H2SO4 0,5M và HCl 1M, thu được dung dịch X chứa 19,83 gam chất tan. Thể tích dung dịch NaOH 1M và KOH 0,6M cần lấy để phản ứng vừa đủ với chất tan trong dung dịch X là:
A. 160,0 ml
B. 225,0 ml
C. . 180,0 ml
D. 200,0 ml
Giải thích: Đáp án D
Glutamic: 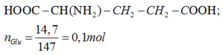
Ta có ∶ Glu + (HCl,H2SO4) ⟶ Muối
Bảo toàn khối lượng ta có :
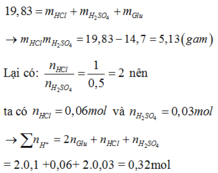
Suy ra số mol OH− cần để phản ứng với số chất tan trong dung dịch X cũng là số mol OH−phản ứng với tổng số mol H+
![]()
Đúng 0
Bình luận (0)
Cho 14,7 gam axit glutamic vào dung dịch H2SO4 0,5M và HCl 1M, thu được dung dịch X chứa 19,83 gam chất tan. Thể tích dung dịch NaOH 1M và KOH 0,6M cần lấy để phản ứng vừa đủ với chất tan trong dung dịch X là: A. 160,0 ml B. 225,0 ml C. . 180,0 ml D. 200,0 ml
Đọc tiếp
Cho 14,7 gam axit glutamic vào dung dịch H2SO4 0,5M và HCl 1M, thu được dung dịch X chứa 19,83 gam chất tan. Thể tích dung dịch NaOH 1M và KOH 0,6M cần lấy để phản ứng vừa đủ với chất tan trong dung dịch X là:
A. 160,0 ml
B. 225,0 ml
C. . 180,0 ml
D. 200,0 ml
Cho 14,7 gam axit glutamic vào dung dịch
H
2
S
O
4
0,5M và HCl 1M, thu được dung dịch X chứa 19,83 gam chất tan. Thể tích dung dịch NaOH 1M và KOH 0,6M cần lấy để phản ứng vừa đủ với chất tan trong dung dịch X là: A. 180,0 ml B. 200,0 ml C. 160,0 ml D. 225,0 ml
Đọc tiếp
Cho 14,7 gam axit glutamic vào dung dịch H 2 S O 4 0,5M và HCl 1M, thu được dung dịch X chứa 19,83 gam chất tan. Thể tích dung dịch NaOH 1M và KOH 0,6M cần lấy để phản ứng vừa đủ với chất tan trong dung dịch X là:
A. 180,0 ml
B. 200,0 ml
C. 160,0 ml
D. 225,0 ml
Cho 27,4 gam bari vào 400 gam dung dịch CuSO4 3,2% , thu được khí A , kết tủa B và dung dịch C.
1. Tính thể tích khí A (đktc) và xác định kết tủa B gồm những chất nào.
2. Nung kết tủa B ở nhiệt độ cao đến khối lượng không đổi thì thu được bao nhiêu gam chất rắn?
Trộn dung dịch chứa 20,8 gam bari clorua vào dung dịch chứa 14,2 gam natri sunfat thu được sản phẩm trong đó có 23,3 gam bari sunfat và m gam natri clorua. Hãy tính giá trị của m
công thức về khối lượng
mBaCl2 + mNa2SO4 = mBaSO4 + mNaCl
20.8 + 14.2 = 23.3 + mNaCl
35 = 23.3 + mNaCl
mNaCl = 35 - 23.3 = 11.7
Đúng 0
Bình luận (0)
Giải
Theo định luật bảo toàn khối lượng, ta có:
mBaCl2 + mNa2SO4 = mBaSO4 + mNaCl
-> mNaCl = (mBaCl2 + mNa2SO4) - mBaSO4
-> mNaCl = (20,8 + 14,2) - 23,3
-> mNaCl = 11,7g
CHÚC BẠN HỌC TỐT NHA ! ![]()
![]()
![]()
![]()
Đúng 0
Bình luận (0)
Theo ĐLBTKL:
mBaCl2+mNa2SO4=mBaSO4+mNaCl
hay 20,8+14,2=23,3+mNaCl
=>mNaCl=11,7(g)
Chúc bạn học tốt![]()
Đúng 0
Bình luận (0)
hòa tan hoàn toàn một hỗn hợp có chứ 13,8 gam kim loại natri và 13,7 gam kim loại bari vào cốc chứa 500ml nước .Sau pảnh ứng thu được dung dịch chứa Natri Hidroxt, Bari hidroxit và khí hidro
a. viết pt phản ứng hóa học
b.tính thể tích khí hidro sinh ra
c. nếu cho mẩu giấy quỳ tím vào dung dịch thu được sau phản ứng thì giấy quỳ tím hóa màu gì?
a, PT: \(2Na+2H_2O\rightarrow2NaOH+H_2\)
\(Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\)
b, Ta có: \(\left\{{}\begin{matrix}n_{Na}=\dfrac{13,8}{23}=0,6\left(mol\right)\\\end{matrix}\right.\)
\(n_{Ba}=\dfrac{13,7}{137}=0,1\left(mol\right)\)
Theo PT: \(n_{H_2}=\dfrac{1}{2}n_{Na}+n_{Ba}=0,4\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,4.22,4=8,96\left(l\right)\)
c, Quỳ tím chuyển xanh.
Bạn tham khảo nhé!
Đúng 2
Bình luận (1)
a) PTHH: \(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\uparrow\)
\(Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\uparrow\)
b) Theo PTHH: \(n_{H_2}=\dfrac{1}{2}n_{Na}+n_{Ba}=\dfrac{1}{2}\cdot\dfrac{13,8}{23}+\dfrac{13,7}{137}=0,4\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,4\cdot22,4=8,96\left(l\right)\)
c) Quỳ tím hóa xanh
Đúng 1
Bình luận (1)