100ml dung dịch H2SO4 0,1M tác dụng với 100ml KOH 0,1M COI H2SO4 phân li hoàn toàn 2 nấc. tính pH thu được sau phản ứng

Những câu hỏi liên quan
Cho 100ml dung dịch X chứa KOH 0,13M và
Ba
(
OH
)
2
0,1M tác dụng với 200ml dung dịch
H
2
SO
4
x mol/lít. Sau khi phản ứng kết thúc thu được dung dịch có pH 2. Giá trị của x là A. 0,03 B. 0,09 C. 0,06 D. 0,045
Đọc tiếp
Cho 100ml dung dịch X chứa KOH 0,13M và Ba ( OH ) 2 0,1M tác dụng với 200ml dung dịch H 2 SO 4 x mol/lít. Sau khi phản ứng kết thúc thu được dung dịch có pH = 2. Giá trị của x là
A. 0,03
B. 0,09
C. 0,06
D. 0,045
Chọn B
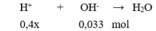
Dung dịch sau phản ứng có pH = 2 < 7 nên dung dịch sau phản ứng có H + dư
→ 0,4x – 0,033 = 10 - 2 .0,3 → x = 0,09
Đúng 0
Bình luận (0)
Bài 1: Cho 100ml dung dịch H2SO4 có pH=2 tác dụng với 100ml dung dịch NaOH 0,01M. Tính nồng độ mol/l của các ion và pH của dung dịch sau phản ứng? ( Coi H2SO4 điện li hoàn toàn cả 2 nấc).
Bài 2: Lấy 200ml dung dịch H2SO4 có pH=1, rồi thêm vào đó 0.88g NaOH. Tính pH của dung dịch thu được? ( Coi H2SO4 điện li hoàn toàn cả 2 nấc).
Bài 1.
\(n_{H^+}=2n_{H_2SO_4}=2.10^{-2}.0,1=0,002\) mol
\(n_{OH^-}=n_{NaOH}=0,01.0,1=0,001\) mol
\(H^++OH^-\rightarrow H_2O\)
0,001<-0,001
\(\Rightarrow n_{H^+}\text{còn}=0,002-0,001=0,001\) mol
\(\Rightarrow\left[H^+\right]=\dfrac{0,001}{0,2}=0,005\) mol/lít
\(\Rightarrow pH=-lg\left[H^+\right]=-lg\left(\dfrac{0,001}{0,2}\right)=2,3\)
\(H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\)
0,0005<--0,001------> 0,001
\(Na_2SO_4\rightarrow2Na^++SO_4^{2-}\)
0,001 ------>0,002-->0,001
\(H_2SO_4\rightarrow2H^++SO_4^{2-}\)
0,0005--->0,001-->0,0005
\(\Rightarrow\left[Na^+\right]=\dfrac{0,002}{0,2}=0,01\) mol/lít; \(\left[SO_4^{2-}\right]=\dfrac{0,001+0,0005}{0,2}=0,0075\) mol/lít
\(\left[H^+\right]=0,005\) mol/lít
Đúng 1
Bình luận (1)
Bài 2.
200 ml dung dịch H2SO4 có pH = 1 nên \(\left[H^+\right]=0,1\)M
\(\Rightarrow n_{H^+}=2n_{H_2SO_4}=2.0,1.0,2=0,04\) mol
\(n_{OH^-}=n_{NaOH}=\dfrac{0,88}{40}=0,022\) mol
\(H^++OH^-\rightarrow H_2O\)
0,022<-0,022
\(\Rightarrow n_{H^+}\text{còn}=0,04-0,022=0,018\) mol
\(\Rightarrow pH=-lg\left[H^+\right]=-lg\left(\dfrac{0,018}{0,2}\right)=1,046\)
Đúng 1
Bình luận (0)
Dung dịch X thu được khi trộn một thể tích dung dịch H2SO4 0,1M với một thể tích dung dịch HCl 0,2M. Dung dịch Y chứa NaOH 0,2M và Ba(OH)2 0,1M. Đổ 100 ml dung dịch X vào 100 ml dung dịch Y , khuấy đều để phản ứng xảy ra hoàn toàn thu được 200 ml dung dịch X có pH a và m gam kết tủa Y ( Coi H2SO4 điện ly hoàn toàn cả 2 nấc). Giá trị của a và m lần lượt là : A. 13 và 1,165 B. 7 và 2,330 C. 1 và 2,330 D. 7 và 1,165
Đọc tiếp
Dung dịch X thu được khi trộn một thể tích dung dịch H2SO4 0,1M với một thể tích dung dịch HCl 0,2M. Dung dịch Y chứa NaOH 0,2M và Ba(OH)2 0,1M. Đổ 100 ml dung dịch X vào 100 ml dung dịch Y , khuấy đều để phản ứng xảy ra hoàn toàn thu được 200 ml dung dịch X có pH = a và m gam kết tủa Y ( Coi H2SO4 điện ly hoàn toàn cả 2 nấc). Giá trị của a và m lần lượt là :
A. 13 và 1,165
B. 7 và 2,330
C. 1 và 2,330
D. 7 và 1,165
Đáp án : A
dd X : nH+ = 2nH2SO4 + nHCl = 0,02 mol
dd Y : nOH = nNaOH + 2nBa(OH)2 = 0,04 mol
=> Trong Y : nOH – nH+ = 0,02 mol = nOH- => COH = 0,1M => pH = 13
Đúng 0
Bình luận (0)
Trộn 100ml dung dịch Ba(OH)2 0,5M và 100ml dung dịch KOH 0,5M thu dung dịch X. Cho X tác dụng với 100ml dung dịch H2SO4 1M. Khối lượng kết tủa và giá trị pH của dung dịch thu được sau phản ứng:
$n_{Ba^{2+}} = 0,1.0,5 = 0,05 < n_{SO_4^{2-}} = 0,1$ nên $SO_4^{2-}$ dư
$n_{BaSO_4} = n_{Ba^{2+}} = 0,05(mol)$
$m_{BaSO_4} = 0,05.233 = 11,65(gam)$
$n_{OH^-} = 0,1.0,5.2 + 0,1.0,5 = 0,15(mol)$
$n_{H^+} = 0,1.2 = 0,2(mol)$
$H^+ + OH^- \to H_2O$
$n_{H^+\ dư} = 0,2 - 0,15 = 0,05(mol)$
$V_{dd} = 0,1 + 0,1 + 0,1 = 0,3(lít)$
$[H^+] = \dfrac{0,05}{0,3} = \dfrac{1}{6}M$
$pH = -log( \dfrac{1}{6} ) = 0,778$
Đúng 1
Bình luận (1)
\(n_{Ba^{2+}}=0.1\cdot0.5=0.05\left(mol\right)\)
\(n_{OH^-}=0.1\cdot0.5\cdot2+0.1\cdot0.5=0.15\left(mol\right)\)
\(n_{H^+}=2\cdot0.1\cdot1=0.2\left(mol\right)\)
\(n_{SO_4^{2-}}=0.1\left(mol\right)\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
\(0.05.........0.05.............0.05\)
\(SO_4^{2-}dư\)
\(m_{\downarrow}=0.05\cdot233=11.65\left(g\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(0.15.......0.15\)
\(n_{H^+\left(dư\right)}=0.2-0.15=0.05\left(mol\right)\)
\(\left[H^+\right]=\dfrac{0.05}{0.1+0.1+0.1}=\dfrac{1}{6}\)
\(pH=-log\left(\dfrac{1}{6}\right)=0.77\)
Đúng 0
Bình luận (0)
Câu 36. Hoà tan hoàn toàn 7,8 g kim loại X vào dung dịch HNO3 thu được 0,672 lít khí N2O (đktc). Vậy X có thể làA. Cu B. Fe C. Zn D. AlCâu 37. Trộn 100ml dung dịch H2SO4 0,1M với 100ml dung dịch NaOH 0,1M thu được dung dịch Y. pH của dung dịch Y làA. 2 B. 1,7 C. 12 D. 3Câu 38. Dung dịch X gồm a mol Na+; 0,15 mol K+; 0,1 mol HCO3-; 0,15 mol CO32- và 0,1 mol SO42-. Tổng khối lượng muối trong dung dịch X làA. 33,8 gam B. 48,5 gam. C. 29,5 gam. D. 40,9 gam.Câu 39. Hoà tan m gam Fe vào dung dịch HNO3...
Đọc tiếp
Câu 36. Hoà tan hoàn toàn 7,8 g kim loại X vào dung dịch HNO3 thu được 0,672 lít khí N2O (đktc). Vậy X có thể là
A. Cu B. Fe C. Zn D. Al
Câu 37. Trộn 100ml dung dịch H2SO4 0,1M với 100ml dung dịch NaOH 0,1M thu được dung dịch Y. pH của dung dịch Y là
A. 2 B. 1,7 C. 12 D. 3
Câu 38. Dung dịch X gồm a mol Na+; 0,15 mol K+; 0,1 mol HCO3-; 0,15 mol CO32- và 0,1 mol SO42-. Tổng khối lượng muối trong dung dịch X là
A. 33,8 gam B. 48,5 gam. C. 29,5 gam. D. 40,9 gam.
Câu 39. Hoà tan m gam Fe vào dung dịch HNO3 loãng, dư thu được 1,344 lit khí NO duy nhất (đktc). Giá trị của m là:
A. 1,12 gam. B. 3,36 gam. C. 0,56 gam. D. 5,6 gam.
Câu 40. Cho 13,9 gam hỗn hợp hai kim loại Al và Fe vào dung dịch HNO3 loãng dư, thu được 6,72 lit khí NO (đktc) duy nhất. Phần trăm khối lượng của Al trong hỗn hợp ban đầu là
A. 49,1% B. 21,15 % C. 19,42 % D. 65,9 %
Cho C=12, H=1, O=16, N=14, Zn=65, Al=27, Fe=56, Cu =64, S=32, Na=23, K=39.
có giải bài làm rõ ràng càng tốt ạ . mình cảm ơn
Trộn 100ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M thu được dung dịch X. Tính pH của dung dịch X? A. 8 B. 14 C. 12 D. 13
Đọc tiếp
Trộn 100ml dung dịch hỗn hợp gồm H2SO4 0,05M và HCl 0,1M với 100ml dung dịch hỗn hợp gồm NaOH 0,2M và Ba(OH)2 0,1M thu được dung dịch X. Tính pH của dung dịch X?
A. 8
B. 14
C. 12
D. 13
Đáp án C
nH+ = 0,02 mol; nOH-= 0,04 mol
H+ + OH- → H2O
0,02 0,04
nOH- dư = 0,02 mol; [OH-] dư = 0,02/0,2 = 0,1M suy ra [H+] = 10-13 M suy ra pH = 13
Đúng 0
Bình luận (0)
Trộn 100ml dung dịch chứa H2SO4 0,1M và HNO3 0,3M với 100ml dung dịch chứa Ba(OH)2 0,3M và KOH 0,1M thu được dung dịch X và kết tủa Y. Cho quỳ tím vào dung dịch Y, hiện tượng gì xảy ra ? A. tím chuyển sang đỏ B. quỳ tím chuyển sang xanh C. quỳ tím không chuyển màu D. quỳ tím mất màu
Đọc tiếp
Trộn 100ml dung dịch chứa H2SO4 0,1M và HNO3 0,3M với 100ml dung dịch chứa Ba(OH)2 0,3M và KOH 0,1M thu được dung dịch X và kết tủa Y. Cho quỳ tím vào dung dịch Y, hiện tượng gì xảy ra ?
A. tím chuyển sang đỏ
B. quỳ tím chuyển sang xanh
C. quỳ tím không chuyển màu
D. quỳ tím mất màu
Đáp án B
nH+ = 0,05 mol; nOH- = 0,07 mol
H+ + OH- → H2O
Ta thấy H+ hết, OH- dư nên nhúng quỳ tím vào Y thì quỳ tím chuyển thành màu xanh.
Đúng 0
Bình luận (0)
(ĐS: pH = 2).
Bài 10. Cho 40 ml dung dịch H2SO4 0,375M vào 160 ml dung dịch chứa đồng thời NaOH 0,16M và KOH 0,04M thu được dd X.
Tính pH của dung dịch X. (Coi H2SO4 phân li hoàn toàn ở 2 nấc). (ĐS: pH = 12)
Nếu cô cạn dd X thì thu được bao nhiêu gam chất rắn khan.
Trộn 100ml dung dịch gồm Ba(OH)2 0,1M và NaOH 0,1M với 400ml dung dịch gồm H2SO4 0,0375M và HCl 0,0125M thu được dung dịch X. Tính pH của dung dịch X ?
A. 1
B. 2
C. 3
D. 4
Đáp án B
nOH-= 0,03 mol; nBa2+ = 0,01 mol
nH+ = 0,035 mol; nSO4(2-) = 0,015 mol
H+ + OH- → H2O
0,035 0,03
nH+ dư = 5.10-3 mol; [H+] dư = 5.10-3/0,5 = 0,01 suy ra pH = 2
Đúng 1
Bình luận (0)











