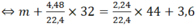Bài 1: Đốt cháy 4,48 lít CH4(đktc) trong O2 thu được CO2 và H2O
a)Tính mH2O thu được
b)Tính VO2(đktc) cần dùng
c)Tính mCO2 thu được (định luật bảo toàn khối lượng)
Bài 2: Đốt cháy hết P trong O2 thu được 71 gam P2O5
a)Tính VO2(đktc) cần dùng
b)Tính mP cần dùng (theo định luật bảo toàn khối lượng)