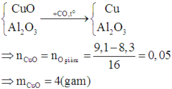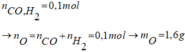dẫn CO dư đi qua ống nghiệm chứa 26,2g chất rắn A gồm Al2O3 và CuO. Kết thúc phản ứng người ta thất khối lượng chất rắn giảm 3,2g. Tính thành phần % về khối lượng mỗi chất có trong rắn A

Những câu hỏi liên quan
Dẫn dòng khí CO đi qua ống sứ chứa 6,1g hỗn hợp A gồm CuO,Al2O3 và 1 oxit của 1 kim loại R đốt nóng tới phản ứng hoàn toàn thì chất rắn còn lại trong ống nghiệm có khối lượng là 4,82g. Toàn bộ lượng chất rắn phản ứng vừa đủ với 150ml dung dịch HCL 1M. Sau phản ứng thấy thoát ra 1,008 lít khí H2(đktc) và còn lại 1,28g chất rắn không tan. Xác định kim loại R và công thức oxit của R trong hỗn hợp A.
Đọc tiếp
Dẫn dòng khí CO đi qua ống sứ chứa 6,1g hỗn hợp A gồm CuO,Al2O3 và 1 oxit của 1 kim loại R đốt nóng tới phản ứng hoàn toàn thì chất rắn còn lại trong ống nghiệm có khối lượng là 4,82g. Toàn bộ lượng chất rắn phản ứng vừa đủ với 150ml dung dịch HCL 1M. Sau phản ứng thấy thoát ra 1,008 lít khí H2(đktc) và còn lại 1,28g chất rắn không tan. Xác định kim loại R và công thức oxit của R trong hỗn hợp A.
Gọi CTHH của oxit kim loại \(R\) là \(R_xO_y\left(x,y\in N\text{*}\right)\)
Đặt kim loại \(R\) có hoá trị \(n\left(n\in N\text{*}\right)\) khi phản ứng với \(HCl\)
Dẫn khí \(CO\) qua ống sứ chứa \(CuO,Al_2O_3,R_xO_y\), chỉ có \(CuO,R_xO_y\) tham gia phản ứng, \(Al_2O_3\) thì không. Vậy hỗn hợp thu được gồm \(Cu,Al_2O_3,R\)
PTHH:
\(CuO+CO\xrightarrow[]{t^o}Cu+CO_2\left(1\right)\)
\(R_xO_y+yCO\xrightarrow[]{t^o}xR+yCO_2\left(2\right)\)
Áp dụng ĐLBTNT:
\(m_{O\left(CuO,R_xO_y\right)}=6,1-4,82=1,28\left(g\right)\\ \rightarrow n_{O\left(CuO,R_xO_y\right)}=\dfrac{1,28}{16}=0,08\left(mol\right)\)
\(n_{HCl}=0,15.1=0,15\left(mol\right)\\ n_{H_2}=\dfrac{1,008}{22,4}=0,045\left(mol\right)\)
Cho hỗn hợp chất rắn gồm \(Cu,R,Al_2O_3\) phản ứng với dd \(HCl\), thấy có chất rắn không tan là \(Cu\)
\(\rightarrow n_{Cu}=\dfrac{1,28}{64}=0,02\left(mol\right)\)
Theo PTHH (1): \(n_{O\left(CuO\right)}=n_{Cu}=0,02\left(mol\right)\)
\(\rightarrow n_{O\left(R_xO_y\right)}=0,08-0,02=0,06\left(mol\right)\)
Theo CTHH \(R_xO_y:n_R=\dfrac{x}{y}n_O=\dfrac{0,06x}{y}\left(mol\right)\)
PTHH: \(2R+2nHCl\rightarrow2RCl_n+nH_2\left(3\right)\)
\(\dfrac{0,09}{n}\)<-0,09--------------->0,045
\(\rightarrow n_{HCl\left(Al_2O_3\right)}=0,15-0,09=0,06\left(mol\right)\)
PTHH: \(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\left(4\right)\)
0,01<----0,06
\(\rightarrow m_R=4,82-0,01.102-1,28=2,52\left(g\right)\)
\(\rightarrow M_R=\dfrac{2,52}{\dfrac{0,06x}{y}}=\dfrac{42y}{x}=21.\dfrac{2y}{x}\left(g\text{/}mol\right)\)
Trong CTHH \(R_xO_y\) có hoá trị \(2y\text{/}x\) nên ta xét bảng:
| \(\dfrac{2y}{x}\) | \(1\) | \(2\) | \(3\) | \(\dfrac{8}{3}\) |
| \(M_R\) | \(21\) | \(42\) | \(63\) | \(56\) |
| \(Loại\) | \(Loại\) | \(Loại\) | \(Fe\) |
Vậy \(R\) là \(Fe\)
Ta có: \(\dfrac{2y}{x}=\dfrac{8}{3}\Leftrightarrow\dfrac{x}{y}=\dfrac{3}{4}\)
Vì \(x,y\in N\text{*}\rightarrow\left\{{}\begin{matrix}x=3\\y=4\end{matrix}\right.\)
Vậy CTHH của oxit là \(Fe_3O_4\)
Đúng 1
Bình luận (0)
tham khảo:
Gọi CTHH của oxit là RxOy
Al2O3 không phản ứng với CO
CuO + CO → Cu + CO2
Hỗn hợp chất rắn tác dụng với HCl là kim loại R
RxOy + yCO → xR +yCO2
Chất rắn gồm: Al2O3, R, Cu
Al2O3 +6HCl → 2AlCl3 +3H2O (1)
2R + 2nHCl → 2RCln + nH2 (2)
(n là hóa trị của R)
Chất rắn là Cu
→ nCu = 1,28:64=0,02mol
nCuO = nCu = 0,02mol
nHCl = 0,15 .1=0,15mol
nH2 = 1,008:22,4=0,045 mol
nHCl(2) = 2nH2 = 0,045.2 = 0,09mol
nHCl (1) = 0,15 – 0,09 = 0,06mol
nAl2O3 = 1/6.nHCl (1) = 0,06/6 = 0,01 mol
mRxOy = 6,1 – mCuO – mAl2O3= 0,02.80+0,01.102= 3,48g
Khối lượng O mất đi khi bị khử bởi CO: 6,1 – 4,28 = 1,28g
→ nO mất đi = 1,28 : 16 = 0,08mol
nO mất đi = nO trong RxOy + nO trong CuO = 0,08
→ nO trong RxOy = 0,08 – 0,02 = 0,06 mol
→nRxOy = 0,06/y mol
mRxOy = (M R+16y) . 0,06/y = 3,48
→R = 42.y/x
→x = 3; y =4; R = 56
→ R là Fe
dẫn hidro nóng dư đi qua ống chứa 24g hỗn hợp CuO và Fe2O3 cho đến khi phản ứng kết thúc lấy chất rắn còn lại trong ống sứ cho tác dụng với dung dịch HCl dư có 4,48 lít khí thoát ra ở điều kiện tiêu chuẩn. Tính khối lượng mỗi chất có trong hỗn hợp ban đầu.
GIÚP TỚ VÓI Ạ, CẦN GẤP Ạ!!
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{H_2}=0,2\left(mol\right)\)
\(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe_2O_3}=0,1.160=16\left(g\right)\)
⇒ mCuO = 24 - 16 = 8 (g)
Đúng 3
Bình luận (1)
Cho luồng khí CO (dư) đi qua ống đựng 9,1g hỗn hợp rắn gồm CuO và Al2O3 nung nóng đến phản ứng hoàn toàn, thu được 8,3g chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là:
A. 4,0g.
B. 0,8g.
C. 8,3g.
D. 2,0g.
13. Thổi rất chậm 2,24 lít (đktc) một hỗn hợp khí gồm CO và H2 qua một ống sứ đựng hỗn hợp Al2O3, CuO, Fe3O4, Fe2O3 có khối lượng là 24 gam dư đang được đun nóng. Sau khi kết thúc phản ứng khối lượng chất rắn còn lại trong ống sứ là A. 22,4 g B. 11,2 g C. 20,8 g D.16,8 g14.X là một oxit sắt. Biết 1,6g X tác dụng vừa hết với 30ml dd HCl 2M. X là oxit nào của sắt? A. FeO B. Fe2O3 C. F...
Đọc tiếp
13. Thổi rất chậm 2,24 lít (đktc) một hỗn hợp khí gồm CO và H2 qua một ống sứ đựng hỗn hợp Al2O3, CuO, Fe3O4, Fe2O3 có khối lượng là 24 gam dư đang được đun nóng. Sau khi kết thúc phản ứng khối lượng chất rắn còn lại trong ống sứ là
A. 22,4 g B. 11,2 g C. 20,8 g D.16,8 g
14.X là một oxit sắt. Biết 1,6g X tác dụng vừa hết với 30ml dd HCl 2M. X là oxit nào của sắt?
A. FeO B. Fe2O3 C. Fe3O4 D. Không xác định được
Dẫn khí H2 dư đi qua hỗn hợp gồm CuO và Fe2O3. Sau phản ứng kết thúc thấy khối lượng chất rắn giảm 25% so với ban đầu.
a. Tính khối lượng các oxit trong hỗn hợp ban đầu.
b. Tính khối lượng các kim loại trong hỗn hợp sau phản ứng.
Em bổ sung khối lượng hỗn hợp ban đầu nhé !
Đúng 0
Bình luận (0)
Thổi rất chậm 2,24 lít (đktc) một hỗn hợp khí gồm CO và
H
2
qua một ống sứ đựng hỗn hợp
A
l
2
O
3
,
C
u
O
,
F
e
3
O
4
,
F
e
2
O
3
có khối lượng là 24 gam dư đang...
Đọc tiếp
Thổi rất chậm 2,24 lít (đktc) một hỗn hợp khí gồm CO và H 2 qua một ống sứ đựng hỗn hợp A l 2 O 3 , C u O , F e 3 O 4 , F e 2 O 3 có khối lượng là 24 gam dư đang được đun nóng. Sau khi kết thúc phản ứng khối lượng chất rắn còn lại trong ống sứ là
A. 16,8 gam.
B. 22,4 gam.
C. 20,8 gam.
D. 11,2 gam.
Cho luồng khí CO (dư) đi qua 9,1 gam hỗn hợp gồm CuO và A l 2 O 3 nung nóng đến khi phản ứng hoàn toàn thấy khối lượng chất rắn giảm 0,8 gam. Khối lượng CuO có trong hỗn hợp ban đầu là
A. 0,8 gam.
B. 8,3 gam.
C. 2,0 gam.
D. 4,0 gam.
Thổi rất chậm 2,24 lít (đktc) một hỗn hợp khí gồm CO và H2qua một ống sứ đựng hỗn hợp Al2O3, CuO, Fe3O4, Fe2O3 có khối lượng là 24 gam dư đang được đun nóng. Sau khi kết thúc phản ứng khối lượng chất rắn còn lại trong ống sứ là A. 20,8 gam B. 16,8 gam C. 22,4 gam D. 11,2 gam.
Đọc tiếp
Thổi rất chậm 2,24 lít (đktc) một hỗn hợp khí gồm CO và H2qua một ống sứ đựng hỗn hợp Al2O3, CuO, Fe3O4, Fe2O3 có khối lượng là 24 gam dư đang được đun nóng. Sau khi kết thúc phản ứng khối lượng chất rắn còn lại trong ống sứ là
A. 20,8 gam
B. 16,8 gam
C. 22,4 gam
D. 11,2 gam.
Thổi rất chậm 2,24 lít (đktc) một hỗn hợp khí gồm CO và H2qua một ống sứ đựng hỗn hợp Al2O3, CuO, Fe3O4, Fe2O3 có khối lượng là 24 gam dư đang được đun nóng. Sau khi kết thúc phản ứng khối lượng chất rắn còn lại trong ống sứ là A. 20,8 gam B. 16,8 gam C. 22,4 gam D. 11,2 gam
Đọc tiếp
Thổi rất chậm 2,24 lít (đktc) một hỗn hợp khí gồm CO và H2qua một ống sứ đựng hỗn hợp Al2O3, CuO, Fe3O4, Fe2O3 có khối lượng là 24 gam dư đang được đun nóng. Sau khi kết thúc phản ứng khối lượng chất rắn còn lại trong ống sứ là
A. 20,8 gam
B. 16,8 gam
C. 22,4 gam
D. 11,2 gam