Tại sao khí đốt các kim loại Al, Fe... thì khối lượng lại tăng lên, còn khí đốt bông vải sợi thì khối lượng lại giảm.

Những câu hỏi liên quan
tại sao khi đốt kim loại Fe hoặc Al thì khối lượng tăng lên còn khi đốt bông,vải sợi thì khối lượng lại giảm?
Fe hoặc Al đốt thì khối lượng tăng lên
Còn Vải sợi có khối lượng sẽ giảm sau khi đốt
Đúng 0
Bình luận (0)
a) Giải thích tại sao sắt để ngoài không khí lâu ngày lại bỉ gỉ
b) nung 1 mẫu kim loại đồng trong không khí thì khối lượng thì mẫu kim loại tăng hay giảm ? vì sao
c) tại sao hỗn hợp hidro và oxi là 1 hỗn hợp nổ
giúp e với ạ , e cảm ơn
Khi H2 phản ứng với O2 sinh ra nước kèm theo nhiệt lượng lớn làm bề mặt nước giãn nở đột ngột , gây nổ mạnh
2H2+O2to→2H2O2H2+O2→to2H2O
Tiếng nổ lớn nhất khi tỉ lệ VH2:VO2=2:1VH2:VO2=2:1
Khi điều chế hidro, để thử tinh khiết hidro, người ta đốt khí thu được. Nếu khí cháy với ngọn lửa màu xanh và tiếng nổ nhẹ thì là hidro tinh khiết.
Đúng 2
Bình luận (0)
1. Chỉ khi có nước và khí oxi tác dụng đồng thời mới làm cho sắt bị gỉ.
Thành phần của gỉ sắt: oxit sắt, sắt hiđrôxít, sắt cacbonat, ...
2. Nếu làm vậy thì các dụng cụ đó nhanh chóng bị hư vì trong vôi, vữa đều có Ca(OH)2 là 1 chất kiềm có thể tác dụng với Al2O3 (vỏ bọc ngoài các đồ dùng bằng nhôm), sau đó nhôm bị ăn mòn.
Pthh: Al2O3 + Ca(OH)2 → Ca(AlO2)2 + H2O
Đúng 3
Bình luận (1)
a) Giải thích tại sao sắt để ngoài không khí lâu ngày lại bỉ gỉ
do bị oxi hóa
3Fe+2O2-to>Fe3O4
b) nung 1 mẫu kim loại đồng trong không khí thì khối lượng thì mẫu kim loại tăng hay giảm ? vì sao
tăng
2Cu+O2-to>2CuO
c) tại sao hỗn hợp hidro và oxi là 1 hỗn hợp nổ
đó là hỗn hợp có thể dãn nở mạnh nhất là tỉ lệ 1:2
2H2+O2-to>2H2O
Đúng 3
Bình luận (0)
Xem thêm câu trả lời
Hãy giải thích tại sao gửi luôn thanh kim loại magie trong không khí thì thấy khối lượng thanh kim loại tăng lên
Ngâm một lá kim loại có khối lượng 50 gam trong dung dịch HCl. Sau khi thu được 336ml khí H2 (đktc) thì khối lượng lá kim loại giảm 1,68 %. Kim loại đó là :
A. Zn.
B. Fe.
C. Al.
D. Ni.
Đáp án B.
Khối lượng kim loại phản ứng là 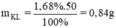
Số mol H2 là 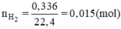
2M + 2n HCl → 2MCl2 + nH2
Số mol của M là:
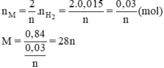
→ {n = 2, M = 56} → M: Fe
Đúng 0
Bình luận (0)
Đặt kim loại cần tìm là X, có hóa trị n
Khối lượng kim loại giảm 1,68% → mX phản ứng = 50.1,68% = 0,84 gam
PTHH: 2X+ 2nHCl → 2XCln + nH2
Ta có: nX = (2/n).nH2 ⇔ (0,84/X) = (0,015.2/n)
⇔ X = 28n
Vậy X là Fe
B nha
Đúng 0
Bình luận (0)
hãy giải thích vì sao khi ta để thanh sắt (Iron) ở ngoài không khí ẩm thì thấy khối lượng của thanh sắt (Iron) tăng lên. Còn khi nung nóng đá vôi (calcium carbonate) lại thấy khối lượng bị giảm đi?
Vì khi để thanh sắt ngoài không khí, thanh sắt sẽ bị rỉ sét tạo thành oxit của sắt nên khối lượng tăng lên do chất rỉ của sắt có chứa ngtố oxi
Nung đá vôi lên thì có khí CO2 thoát ra nên khối lượng giảm
\(CaCO_3\xrightarrow[]{t^0}CaO+CO_2\uparrow\)
Đúng 1
Bình luận (0)
Đốt 40,6g hỗn hợp kim loại gồm Al và Zn trong bình đựng khí Clo dư. Sau một thời gian ngừng pứ thu đc 65,45g hỗn hợp gồm 4 chất rắn. Cho hỗn hợp rắn này tan hết vào dd HCl thì đc V(lít) H2(đktc). Dẫn V(lít) khí này đi qua ống đựng 80g CuO nung nóng. Sau 1 thời gian thấy trong ống còn lại 72,32g chất rắn và chỉ có 80% H2 đã pứ. Xác định % khối lượng các kim loại trong hh kim loại Al-Zn
1./ Dẫn luồng khí H2 qua ống đựng CuO:
CuO + H2 → Cu + H2O
a a a
Khối lượng chất rắn giảm:
Δm = m(CuO pư) - m(Cu) = 80a - 64a = 80 - 72,32 = 7,68g
⇒ a = 7,68/16 = 0,48g
Số mol H2 tham gia pư: n(H2) = 0,48/80% = 0,6mol
Theo ĐL bảo toàn nguyên tố, số mol HCl tham gia pư là: n(HCl pư) = 2.n(H2) = 1,2mol
Theo ĐL bảo toàn khối lượng:
m(hh rắn) + m(HCl pư) = m(muối) + m(H2) ⇒ m(muối) = m(hh rắn) + m(HCl pư) - m(H2)
⇒ m(muối) = 65,45 + 0,12.36,5 - 0,6.2 = 108,05g
Gọi x, y là số mol Al và Zn có trong hh KL ban đầu.
m(hh KL) = m(Al) + m(Zn) = 27x + 65y = 40,6g
m(muối) = m(AlCl3) + m(ZnCl2) = 133,5x + 136y = 108,05g
⇒ x = 0,3mol và y = 0,5mol
Khối lượng mỗi kim loại:
m(Al) = 0,3.27 = 8,1g; m(Zn) = 65.0,5 = 32,5g
Thành phần % khối lượng mỗi kim loại:
%Al = 8,1/40,6 .100% = 19,95%
%Zn = 32,5/40,6 .100% = 80,05%
Đúng 1
Bình luận (1)
Khi ta đốt lửa khói bốc lên cao vì
A.Khối lượng của không khí giảm khi đốt nóng
B.Khối lượng riêng của khoong khí giảm khi bị đốt nóng
C.Thể tích không khí giảm khi bị đốt nóng
D. Khối lượng của không khí tăng khi bị đốt nóng
Đốt cháy hoàn toàn một mẩu kim loại sắt trong lọ chứa 0,896 lít khí oxi (đktc) thì thu được được oxit sắt từ.
a. Tính khối lượng kim loại sắt đã phản ứng
b.Tính khối lượng oxit sắt từ thu được
Cho biết : Fe = 56 , O = 16
\(n_{O_2}=\dfrac{0.896}{22.4}=0.04\left(mol\right)\)
\(3Fe+2O_2\underrightarrow{^{^{t^0}}}Fe_3O_4\)
\(0.06......0.04.......0.02\)
\(m_{Fe}=0.06\cdot56=3.36\left(g\right)\)
\(m_{Fe_2O_3}=0.02\cdot232=4.64\left(g\right)\)
Đúng 5
Bình luận (0)
3Fe+2O2-to>Fe3O4
0,06----0,04-----0,02 mol
n O2=\(\dfrac{0,896}{22,4}\)=0,04 mol
=>m Fe=0,06.56=3,36g
=>m Fe3O4=0,02.232=4,64g
Đúng 4
Bình luận (1)
a. -PTHH xảy ra: 3Fe+2O2→Fe3O4.
-nO2=\(\dfrac{V}{22,4}=\dfrac{0,896}{22,4}=0,04\)(mol) (bonus: ở trường mình là dùng 24,79 nhé:)
- Theo PTHH ta có:
3.nFe=2.nO2=nFe3O4=0,04 (mol)
=>nFe=\(\dfrac{0,04}{3}=\dfrac{1}{75}\)(mol)
=>mFe=M.n=56.\(\dfrac{1}{75}\)=0,75(g).
b. nFe3O4=0,04 (mol)
=>mFe3O4=M.n=232.0,04=9,23(g)
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Câu 20. Khi đốt cháy hoàn toàn 18,4 gam hh Zn và Al thì cần 5,6 lít khí O2 (đktc). Tính % khối lượng mỗi kim loại trong hh đầu.
Gọi số mol Zn, Al là a, b (mol)
=> 65a + 27b = 18,4 (1)
\(n_{O_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
b-->0,75b
2Zn + O2 --to--> 2ZnO
a-->0,5a
=> 0,5a + 0,75b = 0,25 (2)
(1)(2) => a = 0,2 (mol); b = 0,2 (mol)
=> \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,2.65}{18,4}.100\%=70,65\%\\\%m_{Al}=\dfrac{0,2.27}{18,4}.100\%=29,35\%\end{matrix}\right.\)
Đúng 3
Bình luận (0)
\(2Zn+O_2\rightarrow 2ZnO \)
\(4Al+3O_2\rightarrow 2Al_2O_3 \)
\(n_{O_2}=\dfrac{5,6}{22,4}=0,25(mol) \)
\(Theo PT : x = 0,2 mol ; y = 0,2 mol \)
\(\%\)\(m_{Zn}=\dfrac{0,2.65}{18,4}.100\)\(\%\)\(=70,65 \)\(\%\)
\(\%\)\(m_{Al}=100\)\(\%\)\(-70,65=29,35\)\(\%\)
Đúng 2
Bình luận (0)



























