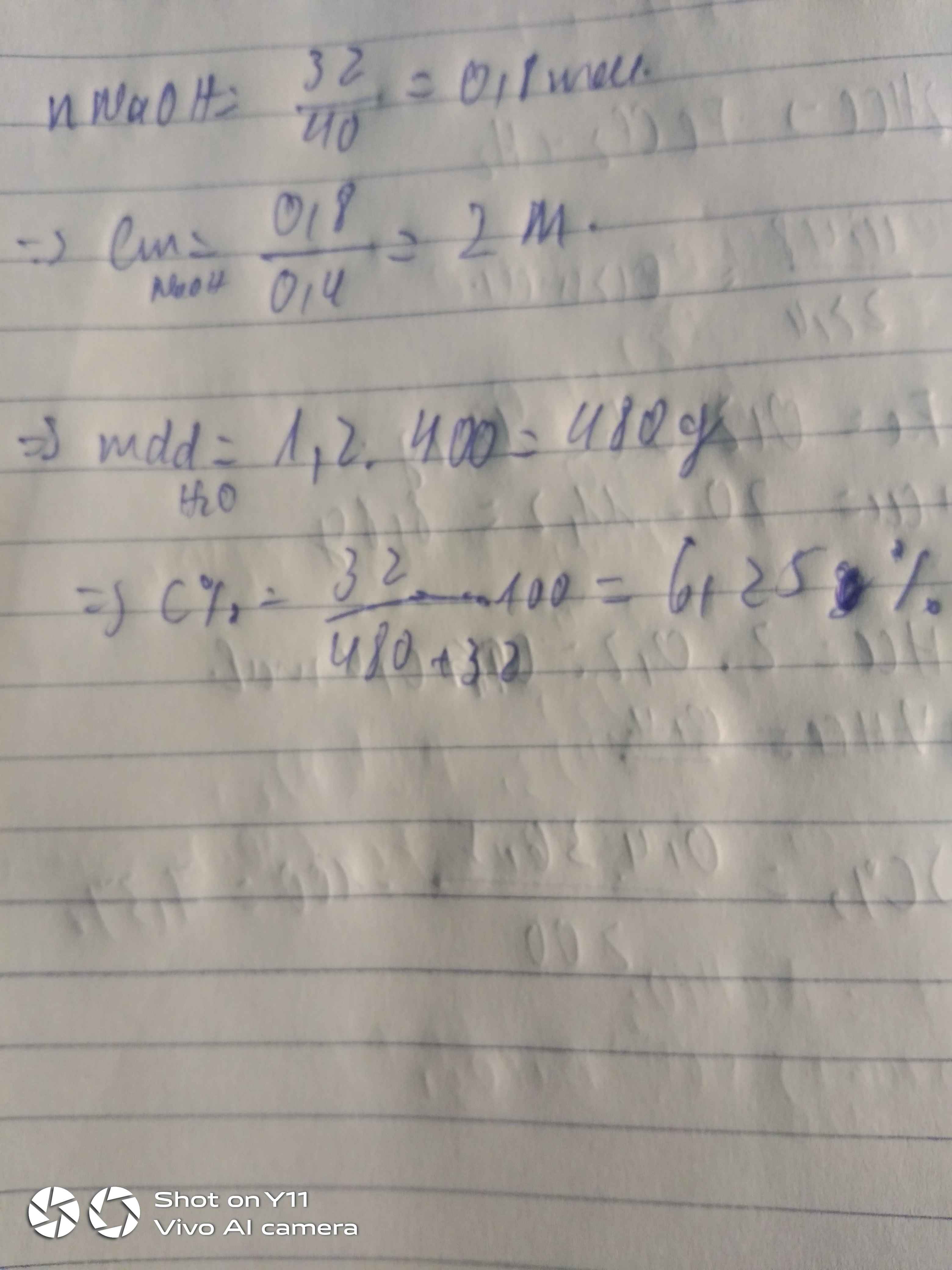tính số mol của 200ml dd HNO3 3,15% d=1,2g/ml

Những câu hỏi liên quan
tính nồng độ mol của dd sau: 300g dd KOH 5,6% d=1,045 g/ml
tinh nồng độ % của dd sau: 300ml dd NaOH 2M d=1,02 g/ml
tính số mol của 200ml dd HNO3 3,15% d=1,2g/ml
tính kl của 150g dd HCL 2M d=1,025g/ml
Lần sau đừng đăng nhiều bài tập trong 1 câu hỏi, vì chỉ được trả lời 1 câu. :))
Câu 1: tính nồng độ mol của dd sau: 300g dd KOH 5,6% d=1,045 g/ml.
Ta có: \(C_{M_{KOH}}=\dfrac{10.5,6.1,045}{56}=1,045\left(M\right)\)
Vậy nồng độ mol của dung dich KOH là 1,045M
Đúng 0
Bình luận (0)
Trộn 200ml dd NaOH 1M vào 300 ml dd H2SO4 1,5M thu được dd D.
a. Tính nồng độ mol/lít các chất trong dung dịch D.
b. Tính thể tích dd Ca(OH)2 10% (d=1,2g/mL) để trung hoà dung dịch D.
\(n_{NaOH}=0,2.1=0,2\left(mol\right)\\ n_{H_2SO_4}=0,3.1,5=0,45\left(mol\right)\)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
0,2------->0,1--------->0,1
Xét \(\dfrac{0,2}{2}< \dfrac{0,45}{1}\Rightarrow\) \(H_2SO_4\)dư
Trong dung dịch D có:
\(\left\{{}\begin{matrix}n_{H_2SO_4}=0,45-0,1=0,35\left(mol\right)\\n_{Na_2SO_4}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}CM_{H_2SO_4}=\dfrac{0,35}{0,5}=0,7M\\CM_{Na_2SO_4}=\dfrac{0,1}{0,5}=0,2M\end{matrix}\right.\)
b
\(Ca\left(OH\right)_2+H_2SO_4\rightarrow CaSO_4+2H_2O\)
0,35<---------0,35
\(V_{Ca\left(OH\right)_2}=\dfrac{0,35.74}{1,2}=\dfrac{259}{12}\approx21,58\left(ml\right)\\ \Rightarrow V_{dd.Ca\left(OH\right)_2}=\dfrac{\dfrac{259}{12}.100\%}{10\%}=\dfrac{1295}{6}\approx215,83\left(ml\right)\)
Đúng 2
Bình luận (0)
Cho 100g dd AgNO3 25,5% ( D= 1,2g/ml) phản ứng với 100 ml dd ZnCl2 17% ( D= 1,2g/mol). Tính nồng độ mol và C% của chất có trong dd sau
*giúp mình với, cảm ơn ạ
\(m_{AgNO3}=\frac{100}{100\%}.25,5\%=25,5\left(g\right)\)
\(\Rightarrow nAgNO3=\frac{25,5}{170}=0,15\left(mol\right)\)
\(m_{dd_{ZnCl2}}=100.1,2=120\left(g\right)\)
\(\Rightarrow m_{ZnCl2}=\frac{120}{100\%}.17\%=20,4\left(g\right)\)
\(\Rightarrow n_{ZnCl2}=\frac{20,4}{136}=0,15\left(mol\right)\)
PTHH: 2AgNO3 + ZnCl2 ----> Zn(NO3)2 + 2AgCl↓
bđ (mol): 0,15 0,15
pư (mol): 0,15 ----> 0,075 ----> 0,075 ------> 0,15
sau (mol): 0..........0,075 ...........0,075...........0,15
Sau pư thu được Zn(NO3)2: 0,075 (mol) và ZnCl2 dư: 0,075 (mol)
\(\Rightarrow\text{mZn(NO3)2 = 0,075.189 = 14,175 (mol)}\)
\(\Rightarrow\text{mZnCl2 dư = 0,075.136 = 10,2 (g)}\)
\(\text{mdd sau pư = mdd AgNO3 + mdd ZnCl2 - mAgCl}\)
= 100 + 120 - 0,15.143,5
=198,475 (mol)
Nồng độ phần trăm của chất có trong dung dịch sau là:
\(C\%_{Zn\left(NO3\right)2}=\frac{14,175}{198,475}.100\%=7,14\%\)
\(C\%_{ZnCl2}=\frac{10,2}{198,475}.100\%=5,14\%\)
Cho 360 gam dd Na2CO3 21,2% (D=1,2g/ml) vào 200 ml dd H2SO4 2,5M (d=1,1) sau phản ứng thu được dd A và khí CO2.
a. Tính thể tích khí CO2 ở đkc.
b. Tính nồng độ % và nồng độ mol/l của các chất trong dd A.
\(n_{Na_2CO_3}=\dfrac{360.21,2\%}{100\%.106}=0,72(mol)\\ n_{H_2SO_4}=2,5.0,2=0,5(mol)\\ PTHH:Na_2CO_3+H_2SO_4\to Na_2SO_4+H_2O+CO_2\uparrow\\ a,\text {Vì }\dfrac{n_{Na_2CO_3}}{1}>\dfrac{n_{H_2SO_4}}{1} \text {nên }Na_2CO_3\text { dư}\\ \Rightarrow n_{CO_2}=n_{H_2SO_4}=0,5(mol)\\ \Rightarrow V_{CO_2}=0,5.22,4=11,2(l)\\\)
\(b,A:Na_2SO_4\\ n_{Na_2SO_4}=n_{H_2SO_4}=0,5(mol)\\ m_{dd_{H_2SO_4}}=200.1,1=220(g);V_{dd_{Na_2CO_3}}=\dfrac{360}{1,2}=300(ml)=0,3(l)\\ \Rightarrow C\%_{Na_2SO_4}=\dfrac{0,5.142}{360+200-0,5.44}.100\%=13,2\%\\ C_{M_{Na_2SO_4}}=\dfrac{0,5}{0,3+0,2}=1M\)
Đúng 0
Bình luận (0)
1/ Phải hòa tan bao nhiêu ml dd HNO3 98% vào 100 ml H2O để dd HNO3 có d = 1,2g/ml ?
2/ Xác định lượng (CH3CO)2O và H2O để pha 500g dd CH3COOH 54%.
Cho 32g NaOH vào nước được 400ml dd có khối lượng riêng D=1,2g/ml . Tính nồng độ mol và nồng độ phần trăm của dung dịch
Cho một thanh sắt có m = 100 g vào 200ml dd AgNO3 (D = 1,2g/ml), sau khi phản ứng kết thúc lấy thanh sắt ra, rửa sạch , làm khô, cân lại thấy = 104,8g
a. Tính CM dd AgNO3 = ?
b. Tính C% dd thu được sau phản ứng ?
300ml dd AgNO3 1M (D=1,2g/ml) tác dụng 200ml dd HCl 2M (D=1,5g/ml).Tính CM, C% các chất trong dd sau phản ứng
cho 8,4g bột sắt tác dụng với 200ml dd HCl 2M ( D= 1,25g/ml), thu được 200ml dung dịch A và V ml khí hidro (dktc)
a) tính V (ml)
b) tính nồng độ mol các chất tan trong dung dịch A
c) tính nồng độ % của chất tan trong dd A
a, \(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
\(n_{HCl}=0,2.2=0,4\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Xét tỉ lệ: \(\dfrac{0,15}{1}< \dfrac{0,4}{2}\), ta được HCl dư.
Theo PT: \(n_{H_2}=n_{Fe}=0,15\left(mol\right)\Rightarrow V_{H_2}=0,15.22,4=3,36\left(l\right)=3360\left(ml\right)\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{FeCl_2}=n_{Fe}=0,15\left(mol\right)\\n_{HCl\left(pư\right)}=2n_{Fe}=0,3\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{HCl\left(dư\right)}=0,4-0,3=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{FeCl_2}}=\dfrac{0,15}{0,2}=0,75\left(M\right)\\C_{M_{HCl\left(dư\right)}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\end{matrix}\right.\)
c, Ta có: \(m_{ddHCl}=1,25.200=250\left(g\right)\)
⇒ m dd sau pư = 8,4 + 250 - 0,15.2 = 258,1 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{FeCl_2}=\dfrac{0,15.127}{258,1}.100\%\approx7,38\%\\C\%_{HCl\left(dư\right)}=\dfrac{0,1.36,5}{258.1}.100\%\approx1,41\%\end{matrix}\right.\)
Đúng 1
Bình luận (0)